Сесия 10 10-ти клас (първа година)
План редоксиреакциите
1. Redox реакция (съпротивление на спукване), степента на окисление.
2. Процесът на окисление, редуциране критично.
3. Процесът на възстановяване, основните оксиданти.
4. двойствеността Редокс.
5. Основните видове IAD (междумолекулни, вътрешномолекулна диспропорциониране).
7. Методи за получаване на ISI уравнения (електронни и електрон-йонна баланс).
Всички химични реакции въз основа на промени в окисление на атомите, участващи в нея могат да бъдат разделени на два типа: IAD (срещащи с промяна на окисление) и IAD.
Степента на окисление - кондиционираната заряд на атома в молекулата, изчислено на предположението, че съществува само в молекулата на йонни връзки.
Пример и и п и г п I о п р е г д л д I п и д п д р п д минути до около л и н д и
Степента на окисление на атомите на прости вещества е нула.
Сумата на сили на окисляване атома в комплекс вещество (молекула) е нула.
Степента на окисление на метални атоми алкални +1.
Степента на окисление на атомите на алкалоземни метали +2.
степента на окисление на борни атоми, алуминиев три.
степента на окисление на един атом водород (в хидриди на алкални и алкалоземни метали -1).
степента на окисление на кислородни атоми -2 (пероксиди в 1).
Всяко OBP е набор от процеси и закрепване на отката електрон.
Процесът на откатни електрони се нарича окисление. Частиците (атоми, молекули или йони) даряват електрони се наричат редуциращи агенти. Степента на окисление на окисление на увеличенията на редуциращ агент. Намаляване средства могат да бъдат частици в по-ниска или междинно окисление. Намаляване средства са най-важните: всички метали под формата на прости вещества, особено активно вещество; С, CO, NH3. PH3. CH4. SiH4. Н2 S и сулфиди, халогениди и метални халогениди, метални хидриди, метални нитриди и фосфиди.
процес Electron свързване се нарича реконструкция. Частиците приемане на електрони, посочени оксиданти. Намаляване на степента на окисление на окислител намалява. Оксиданти могат да бъдат частици от по-висока или междинно окисление. Основни оксиданти неметали прост вещество с висока Електроотрицателност (F2 Cl2 O2 ..), калиев перманганат, хромати и dichromates, нитрати и азотна киселина, концентрирана сярна киселина, перхлорна киселина и перхлорат.
Веществата, съдържащи частици в междинно окислително състояние, могат да действат както като окислители и като редуциращи средства, т.е. проявяват редокс дуалността. Това сярна киселина и сулфити, хипохлориста киселина и хипохлорити, пероксиди и други.
Има три вида на окислително-редукционни реакции.
Междумолекулни OBP - окислителя и редуктор са включени в състава на различни вещества, например:
Вътремолекулната IAD - окислител и редуциращо средство, са част от едно вещество. То може да бъде различни елементи, като например:
или един химичен елемент в различни степени на окисление, например:
Диспропорциониране (автоокисляване-самолечение) - окислител и редуциращият агент е един и същ елемент намира в междинно окисление, например:
Съпротивление на спукване са от голямо значение, тъй като повечето от реакциите се среща в природата, са от този тип (процес на фотосинтеза, изгаряне). Освен това, OBP активно използва от човек в практическото му активност (намаляване на метали, синтез на амоняк):
Можете да използвате електронна везна (електронни схеми), метод или метод за електрон-йонни баланс уравнения за съставяне ЗАМ.
метод електронен баланс:
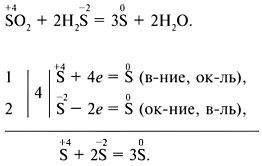
Метод електрон-йонна баланс:
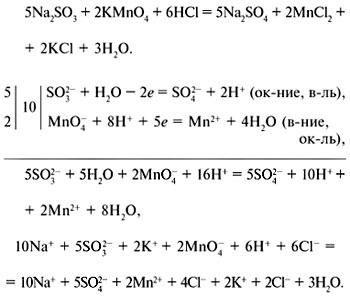
Свързани статии
