1. Състав атома. атомен модел структура.
2. състоянието на електрона в атом.
3. Структурата на електронен слой атоми на 1-4 периоди.
4. Зависимостта на свойствата на елементи на електронна конфигурация. Електроотрицателност. Метални и неметални свойства.
5. Понятието химичната връзка. Комуникационни системи: ковалентна, йонна метал. Полярността на връзката. Valence. Структурните формули.
6. кристална решетка. Зависимостта на свойствата на веществата от тип решетка.
7. Степента на окисление. Редоксисистемите процеси.
Atom - най-малкото химически неделими частици, но частицата има сложна структура. През 1911 г. е предложен Rutherford планетарен модел на атомната структура. Малко по-късно - през 1913 г. е имало теорията на теорията на Бор. Същността на тези теории формулирани както следва:
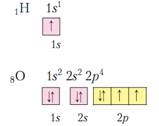
В центъра на атома е положителен ядрото, заема малка част от един атом на пространството. Преместването на електроните около ядрото, те образуват така наречената електрони обвивка. Тяхната обща такса, равна на заряда на атомното ядро, но с обратен знак. Atom - електрически неутрални частици.
атомно ядро се състои от протони и неутрони, са понякога по-долу нуклоните. Различни видове атоми с различен брой протони и неутрони наречени нуклиди. Ядрото съдържа почти всички от масата на атома. протон маса 1 атомни масови единици неутрони маса 1 атомни масови единици електрон маса = 1/1823 атомни масови единици Следователно масата на електрони обвивка е пренебрежимо малък в сравнение с масата на ядрото. Броят на протоните в един атом се нарича номер на протон от атоми. Събиране на атоми със същия брой протони се наричат химичен елемент. Протон номер съвпада с номера на последователност на елемента в MS. Ядрото положително заредена, а от = 1 зареждане на протон, неутронно = 0, заряд на ядрото се определя и броя на протоните е твърде поредния елемент. Сумата на протони и неутрони се нарича масовото число на елемента. Тъй като това е сумата от протони и неутрони определя масата на атома. Сериен номер (протон номер) и маса (нуклон) номер - най-важните характеристики на атом. Техният химичен елемент посочи за знака, например 23 ноември Na. Ако същия брой атоми на протони, но различен брой неутрони, такива атоми са наречени изотопи. Т.е. Na пример 12 до 6 и 13 юни S. Понякога другата страна на елемент марка химическата записва броя на неутроните, т.е. за 12 6 - 12 6 P 6 и за 13 6 - 13 6 P 7 разграничи стабилни и радиоактивни изотопи. Познаването на маса фракция на изотопите на химичен елемент и неговия масов номер, с който може да се изчисли средната атомна маса на елемента.
защото ядрен заряд равна на заряд на електрони обвивка и всеки електронен заряд (1), броя на протоните, равен на броя на електрони. Тези електрони се движат по определени орбити около ядрото.
Този модел на атома е много ясен и полезно. Но възниква въпросът веднага. Според електромагнитната теория, движещи се в орбита с ускорение на електрона трябва непрекъснато да излъчва енергия, и затова ще завит и рано или късно попада в ядрото. По това време, ако е доказано, дискретна електрическа енергия. Ето защо, Бор предположих - орбита електрон не излъчва енергия, това се случва само по време на прехода от една орбитална в друга.
Модерен TCA стана в резултат на размисъл и допълнения на Ръдърфорд и теория на Бор. Най-важното е концепцията концепцията на електронен облак, който заменя концепцията на електрон като частиците. Съвременната теория на атомната структура взема предвид вълнови свойства на електрона.
В двойствената природа на електрона. Както частицата има определена маса и заряд, и вълна - способността да се заобиколи препятствието (дифракция). За електрон не може да бъде едновременно за точно измерване на положението и енергия. Той се движи с голяма скорост и характера на движенията му - една вероятност. Т.е. той не се движи по определена траектория и хаотично в пространството около ядрото, както и вероятността от престоя си в различни точки на това пространство е различна. Това пространство около ядрото където престоя електрон най-вероятно се нарича електронен облак или на електронните орбити на.
Орбитали имат определен размер, форма и са разположени в пространството по определен начин. За да се характеризира свойствата на тези орбитална квантово число се използва. само 4 Има.
Основният квантовата броя определя размера на орбитите и следователно степента на разстояние от ядрото. Това е основният номер (орбитална размер) най-много енергия на електрона зависи. Орбитали приблизително със същия размер за образуване на електрон слой (ниво на електрони). Броят п може да има стойност = 1,2,3,4 ... п и по-стойността, толкова по-общо, електронна енергия. Често структурата на атома представен под формата на диаграма:
т.е. за натрий (№11) +11) 2) 8) 1
Нивата са разделени на поднива. Освен това, броят на възможните поднива равен на броя на нива. Т.е. 1 подслой ниво 1, 2 - 2, 3 и т.н. -3
Поднива се образуват чрез орбитали, идентични не само по размер, но също и във форма. Тази форма определя втора орбитална (орбитален) квантовата номер. Поднива обикновено се отбелязват с букви:
Ниво 2 - 2s, 2P
Ниво 3 - 3 мастни киселини, 3P, 3d
Ниво 4 - 4s, 4P, 4г, 4е ...
Третият квантовата брой се нарича магнитно, той определя ориентацията на орбиталната, в пространството и техния брой в подниво. За редица такива -podurovnya и орбитали на всяко ниво е 1. р-подниво - 3. г -5. За е - 7 ...
Четвъртият брой на орбита характеризира собствения си състояние на електрон в атома, който е, просто, може да бъде представено като момент на самостоятелно въртене на електрона. То може да има само две стойности, т.е. (Опростен) или въртенето в една или друга посока. Тази характеристика се нарича електронно Сервиз и броя - спин. Т.е. електрони, които имат три еднакви квантови числа трябва да са с различна стойност спин.
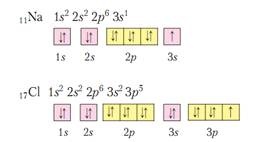
1). принцип Aufbau и принципа на минималната енергия; в стабилно (стационарен) състояние, електроните запълват първо орбитални с по-ниско ниво на енергия. Енергията на електрон зависи от количеството на основните и орбитално квантово число, възходяща орбитални енергии образуват ред:
2). Принципът за Pauli атом не може да бъде два еднакви електрони т. Е. Със същите набор 4 квантови числа. Следователно в един орбитален може да бъде не повече от два електрона, където, с противоположни завъртания.
Орбитали могат да бъдат грубо изобразяват клетки на - клетки. И в една клетка черпим или ↓ ↑. или просто ↓. или просто ↑. Но ↑↑ - това е забранено от принципа на Паули.
3). правило Hund му. По едно подниво стойност на спина на електроните трябва да бъде максимално, което означава, че запълването на електрон подниво настъпи първо от едната, и едва след това - оплождането да бъде място. - забранено!
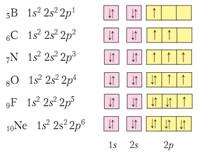
При образуването на химични връзки обикновено присъстват електрони външен електронен слой. Те се наричат валентност. В елементи от подгрупите в образуването на връзки могат да участват и г-електрони. Броят на електроните в външния слой за основна група елемент (и и р компоненти) равен на броя на група съвпада с максимална валентността елемент и максимална степен на окисление.
Най-ниско конфигурация енергия електрони е запълнена с електрони слой - и 2 р 6 (за слой 1 и 2). (Предпочитани енергийни поднива също са запълнени и половина напълнена поднива). Ето защо, всички елементи са склонни да завършат своята електронна слой да бъде конфигуриран. За тази цел елементите се дава или валентните електрони, или те са присъединени, като останалите атоми.
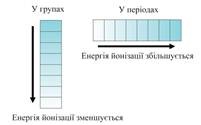

Елементи с висока ЕО са неметали.
Периодите на EA се увеличили с увеличаване на броя на подгрупите - се намалява. Polling е в състояние да се измери от омбудсмана и той разположени елементите в реда:
Знаейки позицията на елемента в електроенергийната система, ние можем да характеризират електронната му структура и свойства.
Характеристики на PS елемент (план)
1) позицията на TS (номер на последователност, период групата, подгрупата, атомно тегло)
2) състав на атоми (брой протони, неутрони, електрони)
3) разпределението на електрони през нивата, поднива, орбитите (структура диаграма електрон формула квантовата клетки).
4) характеристика на електронната структура и свойства на елемент и неговите съединения (номер на електрони слоеве, дали завършен външен електронен слой като електрони нея, което ЕО елемент окисляване характеристика, броят на несдвоени електрони на свободни орбитали възможно валентност елемент характерни elementa- съединения оксиди, хидроксиди LAN);
Заключение: метални или неметални свойства на елемент и сравнение елемент период свойства съседи и подгрупа.
Само инертни газове при стандартни условия в едноатомен състояние. Всички останали, които искат да завършат своите външни електронен слой форма химични връзки. Това желание да има 8 електроните във външния слой се нарича правилото за октет. Обикновено, преди да влезе в химическа реакция атом трябва да получите повече енергия и ще отиде в възбудено състояние.
Химична връзка електронен характер, т.е. образуван от взаимодействието между ядрата и електроните на атомите. Съществуват няколко вида на химичните връзки.
Връзката на ковалентна се образува чрез общи електронни двойки. Тя е типична за неметали, т.е. елементи с високо ЕО.
Разграничаване полярен ковалентна връзка и неполярен ковалентна връзка (KP и CNR). Ако атомите, образуващи връзка са същите, електронната двойка еднакво принадлежи към двата атома и връзката се нарича KNI. Ако атомите са различни, електронна двойка се измества към по-EO атом атома появяват на частичните такси, "поле" връзка CP.
Ако елементите са много различни EA, т.е. метали принадлежат към една и друга за неметали, електроните са напълно прехвърлени на по-EO атом, образуват истински такси на атомите. Атомите стават йони. Комуникацията между йоните са наречени йонни.
Обикновено вещества - метали образуват специален тип химична връзка, която се нарича метал. Това се извършва валентност електрони, които са в обща собственост на всички метални атоми (електрон газ).
Множество от атоми, свързващи заедно образуват вещество. В твърдо състояние може да бъде наредено (кристален) и неподредена (аморфен) структура. Модел кристално състояние на вещество, наречено решетка. В зависимост от вида на частици, които образуват тип решетка на химичното свързване и е обичайно да се разграничат молекулна, йонни, атомна и метал кристална решетка. Колкото по-силна връзка между частиците, по-висока точка на топене по-висока твърдост материал. Полярните връзки, толкова по-голяма вероятността за разтваряне на веществото във вода.
Важна характеристика на елемента е степента на окисление okisleniya.Stepen - това обуславя заплащане. което може да се появи на атом, ако всички електрони, които химическите връзки го измества към по-електроотрицателна атом.
