Някои електролити напълно се разпадат в йони в разтвор. Те се наричат силен.
Други електролити само частично се разпадат в йони, т.е. голяма част от молекулите остава в разтвор в недисоциирана форма. Такива електролити се наричат слаби.
Това свойство на материала не е абсолютно, и не зависи само от неговия характер, но също така и от характера на разтворителя. По-голямата диелектричната константа на разтворителя, по-силна си йонизиращо слабост. По този начин, във водни разтвори (# 949, (Н 2О) = 80). LiCl и NaCl държат като силни електролити. Но ако се разтваря в оцетна киселина (# 949 = 6) или ацетон (# 949 = 21), те започват да проявяват свойствата на слаби електролити.
Водните разтвори на силни електролити са соли, разтворими основи (образувани, обикновено алкални и алкалоземни метали), някои неорганични или минерални киселини (HCI, HBr, HI, Н2 SO4. HNO3 и др.).
В същото време, много органични киселини, някои неорганична киселина (HNO2. HF, Н2 S, Н2 SiO3. Н 3РО 4 и т.н.), неразтворими в H2O база държат като слаби електролити.
Вещества, в които частиците са обвързани с различни видове химични връзки, дисоциират на йони от първите връзки йонни
и след това - върху най-полярни ковалентните връзки
Хетеролитична неполярен или ниска полярност пробие ковалентни връзки в процеса на дисоциация такива вещества обикновено не се срещат.
Количествено метод електролитни молекули на йони гниене се оценява с помощта на степента на електролитната дисоциация # 945; ,
Степента на дисоциация - съотношение на броя на счупени молекули вещество в йони към общия брой на молекулите в разтвора (и разпада nondecomposed):
ND = NO + NH (не- дисоцииран електролит брой молекули в разтвор)
Тъй като броят на материал от отделни частици (N), и тяхната химическа размер (п), свързани чрез уравнението N = N # 8729; NA. степента на дисоциация все още може да се изчисли по различен начин:
За силни електролити # 945; е близо до единство. Почти всички техни молекули в разтвор са в дисоциирана форма, процесът на асоциация е много малък.
В тази връзка, вместо обратимост "" знак дисоциация уравнения на тези вещества даде знак «®» (т.е. използва само в посоката на стрелката гниене), например:
За слаби електролити, степен на дисоциация е много малък (# 945;<<1). Так, для воды при 20 о С α ≈ 1 ∙ 10 –9. Это означает, что только одна молекула из миллиарда распадается на ионы. В растворах слабых электролитов, наряду с диссоциацией, непрерывно протекает и обратный процесс – ассоциация. С течением времени между ними устанавливается химическое равновесие, которое может быть смещено в ту или иную сторону.
В резултат на дисоциация на електролита е увеличение на броя на частиците в разтвора. Това позволява да се определи експериментално степента на дисоциация на измерване на свойствата на разтвора, което зависи само от броя на частиците, съдържащи се в него разтворимото вещество, но не и тяхното естество, размер, тегло. включва точка на кипене и замразяване разтвор на осмотичното налягане и някои други за такива свойства.
За решения на слаби стойности електролити # 945;, дефинирано по различни начини, обикновено е същата и винаги много по-малко от единица, която се съгласява и с теорията на Арениус.
Както се вижда от експериментални изследвания, степента на дисоциация на слаби електролити зависи от температурата на разтвора и неговата концентрация.
Таблица 8. промени в степента на дисоциация на оцетна киселина в зависимост от неговата моларна концентрация в разтвора
ССН3 СООН мол / дм 3
Чрез увеличаване на степента на дисоциация температура увеличава разтвор като където поляризация е по-добре гарантира и улеснява следващите почивка ковалентни връзки в полярните електролитни молекули. Чрез понижаване на температурата # 945; намалява.
се увеличава # 945; и с намаляване на концентрацията на разтвора, т.е. когато те се разреждат (таблица. 8), защото дебелината на разделителните йоните на водния слой стане по-голямо, така че електростатично взаимодействие между тях, в резултат на молекула йонна връзка, по-рядко.
В степен безкрайно разреждане на дисоциация на електролита тенденция да максималната си стойност, т.е. блок (фиг. 30).
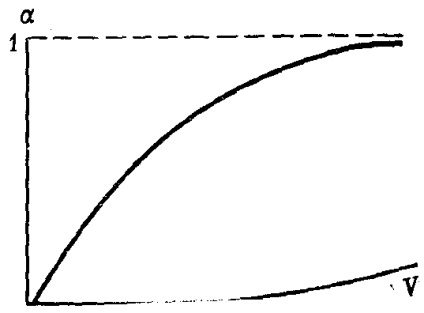
Фиг. 30. Изменението на степента на електролитната дисоциация # 945; разреждане V (схема)
По този начин, за слаби електролити # 945; Тя не е постоянна. Поради способността им да разлагане в йони удобно в сравнение с дисоциационна константа, която е равновесната константа на обратима реакция на електролитна разлагането на молекулите на електролит.
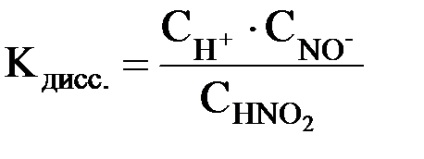
където CH +. SnO2 -. CHNO2 - равновесни моларни концентрации на йони Н + от. NO2 - и HNO2 не- дисоциират молекули.
Дисоциация слаби електролити не зависят от тяхната концентрация в разтвора дори при значително разреждане при тази температура остава постоянна (раздел. 9). С повишаване на температурата на разтвора дисоциационна константа слаби електролити в много случаи, промени в сложен начин (фиг. 31).
Таблица 9. Зависимост на Kdiss. разтвор на оцетна киселина от своя моларна концентрация при Т = 298 К
ССН3 СООН мол / дм 3
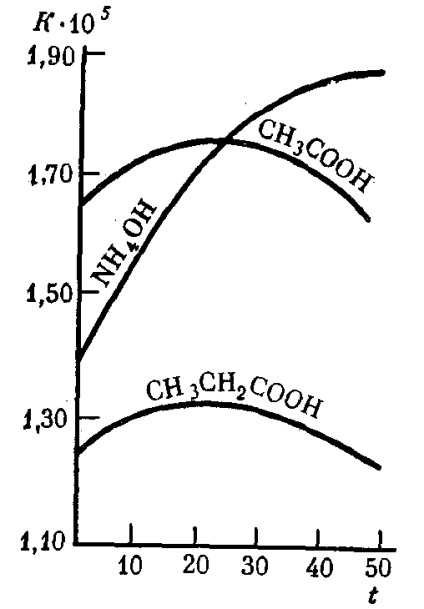
Фиг. 31. Зависимостта на дисоциация константи Knekotoryh слаби електролити във воден разтвор на температура Т (° С)
По-малката Kdiss .. толкова по-слаба е електролит. Например, оцетна киселина (Kdiss. = 1,85 х 10 -5) е почти 220 000 пъти по-силен tsianovodorodnoy HCN (Kdiss. = 4.8 х 10 -10), и около 10 пъти по-слаб от мравчена киселина (Kdiss. = 1, 8 х 10 -4).
Има слаби електролити (полиосновна киселина mnogokislotnye база) процес гниене при което йоните се извършва в стъпки, т.е. на няколко етапа. По този начин всеки етап се характеризира с константа на дисоциация величина.
Например, в етап 2 се извършва дисоциация на сероводород:
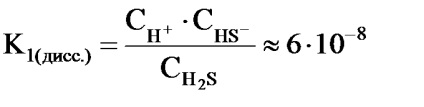
2) HS - Н + + S 2 -
Реакционната дисоциация Общата уравнение Н2 S е както следва:
Н2 S 2Н + + S 2-
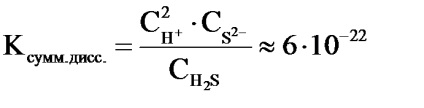
Стойността на константата на дисоциация на общите уравнения и ценностите на отделните етапи на дисоциационните константи са свързани с:
На етап гниене дисоциация на слаб електролит при всеки следващ етап се осъществява в по-малка степен в сравнение с предишните, т.е. К1> К2> K3 и т.н. Това е така, защото разделяне йон не възниква от неутрална молекула (като първа стъпка) и частици с все по-голям заряд и изисква много енергия.
Често, за да се оцени силата на слаб електролит, вместо от стойността на константата на дисоциация използване логаритъм взема с обратен знак (ПК)
В този случай, по-голям рКа стойност, толкова по-слабо е електролита.
Свързани статии
