Ненаситени въглеводороди етиленов серия. или алкени, - въглеводород с обща формула H2N Cn. чиито молекули съдържат една двойна връзка. С атоми, свързани чрез двойна връзка, са в SP 2 хибридизация, двойната връзка е комбинация от - и - връзки. По самата си същност - комуникацията е много различен от -връзките; - връзка е по-силна поради натрупване на облаци електрони извън равнината на молекулата.
Най-простият алкен е етилен. Структурната формула на етилен и Е имат формата:
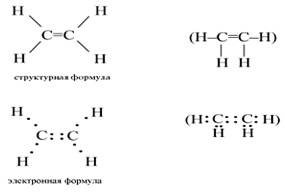
Молекулата на етилен се подложи на хибридизация и - и двата р орбитали атоми С (SP 2 хибридизация). По този начин, всеки С атом има три хибридни орбитали и един не-хибридни р орбити. Две хибридни орбитали атоми C припокриват и образуват С-връзка между атоми. Останалите четири хибридни орбитали С атоми припокриват в същата равнина с четири и орбитали и Н атоми и образуват четири -връзките.
Две нехибридни р орбитали на атомите, се припокриват в равнина, която е перпендикулярна на равнината на -връзките, т.е. една връзка е образувана. Под действието на реагентите -връзките лесно разкъсан.
Етилен - първият член на серията алкеновата хомоложни.
Но бутен -2 молекула може да бъде под формата на две триизмерни форми - цис- и транс-:
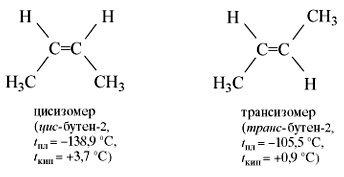
Цис и транс-изомери, имащи различно подреждане на атомите в пространството, много различни физични и химични свойства. Така, двата вида алкени възможна структурна изомерия. Изомерия на въглеродни вериги и позиция изомери на двойната връзка на. Също така е възможно геометрични изомери. Етилен (етена) - безцветен газ с много слаба сладникава миризма, малко по-лек от въздуха, слабо разтворим във вода.
Химичните свойства на етилен от етан е много различна, поради електронната структура на молекулите. Като двойна връзка в молекулата, съставена от - -връзките и етилен могат да свързват два моновалентни атоми или радикали чрез счупване -връзките.
Способността на реакции на присъединяване, типични за всички алкени.
При добавяне към бром алкен (като бром вода) кафяв цвят на бром изчезва бързо. Тази реакция е качеството на двойна връзка.
Ако източникът е асиметричен алкен, реакцията протича по правило Markovnikov на.
Обединяване на халогениди на ненаситени съединения са йонно.
4. Присъединяването вода (реакцията хидратация) на:
Тази реакция се използва за производство на етанол в индустрията.
За типичен окислителната реакция на алкани:
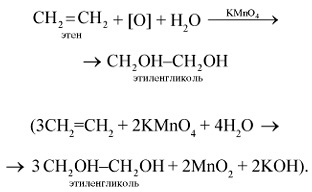
1. Етилен лесно окислява при обикновена температура, например под действието на калиев перманганат. Ако етилен преминава през воден разтвор на калиев перманганат KMnO4. последния характеристика виолетово оцветяване изчезне, настъпва етилен окисляване с калиев перманганат (качествен реакция за двойна връзка):
2. Етилен светлинен пламък изгаря до въглероден оксид (IV) и вода:
3. голям промишлен стойност е частично окисляване на етилен с кислород въздух:
За етилен, като всички ненаситени въглеводороди, характеризиращ се с реакцията на полимеризация. Те възникват при повишена температура и налягане в присъствието на катализатори:
Полимеризацията - серия свързване на идентични молекули в по-голям.
Така, етилен и неговите хомолози, характеризиращ се с допълнение реакцията окисление и полимеризацията.
Свързани статии
