Разтворът - хомогенна система, в която има повече от 2 вещества. Тя може да се състои от: газ - течност и газ - твърди, течни - твърдо вещество и може да бъде хомогенна смес.
Това вещество, което в излишък, често се нарича като разтворител. но фактът, че липсата на - разтворител.
Класификация решения.
1. В зависимост от състоянието на агрегация на решения се отличават:
Газообразни решения - е въздух и други газови смеси.
Течни разтвори - течности хомогенни разтвори, твърди вещества или газове.
Твърдите разтвори - сплави.
Разтворители: вода. бензен, алкохоли, естери, ацетон и т.н.
По време на разтварянето на разтворените йони под влиянието на случаен принцип се движат частици преминават в разтворителя, при което се образува нов разтвор на хомогенна система.
Способността да се образуват различни решения са изразени по различен начин: един могат да бъдат смесени един с друг, и от друга - не. Например разтваряне на солта във вода:
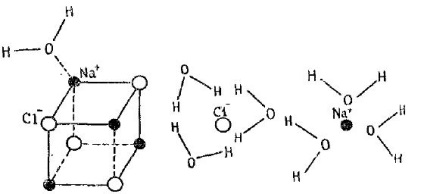
Вода - полярен разтворител, кислород могат да бъдат привлечени електронна двойка Na-Cl.
Като резултат от вибрационното движение на молекулите премине в разтвора на сол (във вода), в резултат на което "отвори" следващия слой на кристала. Постепенно всички слоеве по този начин преминават в разтвора, при което кристалът се разтваря, водата става соленост. Като следствие от частиците на дифузия, които са преминали в разтвор са разпределени по целия обем на разтворителя.
Разтварянето винаги е придружен от обратен процес - кристализацията. Може дойде време, когато разтворът се освобождава от частиците колкото и преминава в разтвор (процеси настъпят едновременно), остатъкът се наблюдава резултата.
- наситен (Този разтвор, където веществото при определена температура вече не се разтваря, т.е. равновесие се наблюдава и процесът е заглавието насищане Такова решение включва максималния брой на разтвореното вещество ...);
- ненаситен;
- свръхнаситен (неустойчиво равновесие системи, в които има произволна промяна в състояние на равновесие, това е съпроводено с отделяне на излишъка от разтворено вещество и разтворът се насища.).
2. В зависимост от броя на разтворените решения се отличават:
- концентрирани разтвори;
- разрежда (малко количество на разтворените) решения.
3. естеството на материали решения са:
- молекулни (nonelectrolytes) разтвори;
- йон (електролитни разтвори провежда електричество) решения.
Свързани статии
