Сред биологично активни вещества, съдържащи се в тялото на метални йони заемат специално място. Така че, biokationy са най-чувствителни "химическа точка" на тялото. Тези хранителни вещества са живот в тялото, главно под формата на водни разтвори на техните соли и комплексни (координация) съединения.
Комплексни съединения са съединения, в кристалната решетка, които са съставни частици възли (комплексни йони), състоящи се от централен атом или йон и неговите околните неутрални молекули или йони. Комплекс йони не са унищожени от тях преминава в разтвор или стопилка.
Структурата на комплексни съединения е обяснено в координация теорията на Werner A. (1893). Според теорията на координация Werner комплексни съединения се характеризират с определена пространствено подреждане на частици, техните съставни молекули. Например: K + | CN - CN - | K +
От горното координация формула показва, че един от йона заема централно положение. Това се нарича атом или йон хелатор. В повечето комплексни агенти са положително заредени метални йони, повечето метали вторични подгрупи (D- и F-елементи), много по-малко - неутрален метални атоми (Fe, Ni) и отрицателно заредени атоми на неметалните елементи (N -3 О -2 S ..). Типични комплексообразуващи агенти са метали като Fe, Cu, Ag, Au, Hg, Co, Cr, Mn, Cd, Ni, Pt, и др. D- и F-елементи. Близо до средство комплексообразувател в определен ред поставя полярни молекули или йони на обратен знак, а понякога и двете, те се наричат лиганди (лиганди), че "свързани" средства. лиганди са от съществено значение:
а) Neutral молекули с дипол характер: Н 2О, NH3. CO, NO, С2 Н4.
б) йони: Н -. О -2. ОН -. Cl -. J -. Br -. CN -. HCO3 -. както и bioligand макромолекули аминокиселини и техни производни, пептиди, протеини, ензими, хормони, нуклеинови киселини и техни фрагменти.
И комплексообразуватели лиганди образуват вътрешната област (означена със скоби) и йоните не са включени в сферата на вътрешната, външната форма на сфера. Вътрешна сфера често в квадратни скоби. Обвинението на комплекса йон е равна на алгебричната сума на таксите и комплексни лиганди. Броят на лиганди, които са разположени в непосредствена близост до централната йон, йон номер nazyvayutsyakoordinatsionnym (CN). възникнат Често две координационни числа, 4, 6. Обикновено броят на координация е два пъти по обвинението му в комплекс йонна Изключение се Fe 2+. за които КН 6 е равно на Pt 4+ - 6.
Ако лигандите са свързани с единична връзка и комплексообразувател заемат координация място във вътрешната област на комплекса, такива лиганди са посочени monodentantnymi (ОН -. Cl -. J -. Br -. CN), две -bidentantnymi (CO3 2- 2- С2 O4). - те държат 2 координационни сайтове. Някои от лигандите, свързани с централната йон и голям брой координационни връзки. Така сред сложни органични съединения са тези, които могат да играят ролята на три, тетра - и още - те се наричат полидентатен. Полидентатен органични лиганди, ограничени от две или повече координатни връзки могат да образуват циклични комплекси.
Molecule комплекси на различни добре дефинирани геометрична структура. Например, две лиганди често са разположени в близост до металния йон, така че централният йон и лиганд 2 са колинеарни. Три лиганди са разположени в ъглите на триъгълник, четири - на ъглите на квадрат или тетраедър (Tetrahedron), шест - в ъглите на октаедър (октаедър), осем - в ъглите на куба. Ако лиганди не са идентични, тогава геометричната форма не може да бъде напълно правилно (изкривен), но, въпреки това, лигандите са фиксирани в определени точки на пространството около централната йон.
Комплексни съединения са класифицирани в зависимост от заряда на комплекс йон и вида на лиганд. Според заряд на комплекс йон са катионни комплекси (комплекса с положителен заряд), анионни (отрицателно зареден комплекс), неутрални (Сложна на нула зареждане).
По вид лигандни комплекси са: acidocomplexes - лиганди са киселинни остатъци (Cl - J - Br - CN - HCO3 - CO3 2- С2 O4 2 -......); хидрокси комплекси от (ОН -); аква комплекси (Н 2О); амино комплекси (NH3); смесен когато Комплексът включва няколко типа лиганд.
Следователно, трябва да знаете, правилното изписване на комплексна съединение с формулата: такса (окисляване) комплексен агент; заряда на лигандите; Броят на координация на комплексообразуващ агент; Външните сфера йони.
При писане формули комплекс йон комплексиране първия символ е показан, след неутрални лиганди посочени за Н2 О,, NH3. След неутрални лиганди следват анионни лиганди. Анионните лиганди са изброени за: N -. На -2. ОН -. прости аниони, аниони на неорганични киселини сложни, аниони на органични киселини.
Комплексни съединения с формула строго четат от дясно на ляво, поддържане на реда в формулата лиганди място. В имената на комплексни съединения, наречени първи анион в поименно случай, а след това катийонна родителен.
I. Ако съединението е включен в комплекс катион. първият се нарича лиганди по реда на тяхното местоположение в комплекса, последвано от името на комплексен агент (руски името на елемента). Скобките в римски цифри показват степента на комплексообразуващ окисление. Неутрални молекули действат като лиганди, имат общо наименование освен амоняк - амин, вода - вода, CO - карбонил, NO - нитрозилхлорид. Отрицателно заредените лиганди, наречени завършваща на "о". Например, N - - хидридо, О 2 - оксо, ОН - - хидроксо, F - - флуоро, CI - - хлор, S -2 - тио, CN - - циано, SO4 -2 - сулфато, СН3СОО - - ацетато , CNS - - тиоцианато, С2 O4 -2 - оксалато. Ако множество лиганди, външната сфера първоначално наречен йон, след лиганди гръцки номера: - 2-ди, три-три и т.н.
Например: името на комплексни катиони
[Co Н2 О (NH3) 5] CL3 - pentaamminakvakobalta хлорид (III)
[Pt (NH3) 5 Cl] CL3 - hloropentaamminplatiny хлорид (IV)
[Pt Н2 О (NH3) 2 OH] NO3 - gidroksodiamminakvaplatiny нитрат (II)
II. Ако съединението е включен комплекс анион. първият се нарича лиганди в реда, посочен по-горе. Наричан по-нататък комплексен агент, използвайки своя корен с латинското наименование на добавяне на сричка - "атомен", след което римски цифри в скоби показват степента на комплексообразуващ окисление. Поне външната област се нарича катион в родителен случай. Например:
К [Ag (CN) 2] - ditsianoargentat (I) Калиев
К2 [Cu CL4] - tetrahlorokuprat (II) калиев
К3 [Fe (CN) 6] - хексацианоферат (III), калиев
Име на неутрални комплекси се състои от имената на лигандите и Руската името на комплексен агент в именителен падеж. В този случай, не е уточнено от валентността на комплексообразувател. Например: [CO (NH3) 3 CL3] - trihlorotriamminkobalt.
[Pt (NH3) 2 CL4] - tetrahlorodiamminplatina.
Вътрешната и външната сфера в молекулите на комплексните съединения свързан йонни връзки. И комплексообразуватели лиганд се свързва чрез ковалентна връзка на механизма за донор-акцептор: лиганди действа като донор на електронна двойка, и комплексообразуващ агент - ролята на акцептор. орбитали на свободното електронната двойка, който е лиганд.
Разпадането на комплексните съединения протича в два етапа. Основно дисоциация на комплекса съединенията е от тип йонизация силни електролити и тече равномерно: [Ag (NH3) 2] Cl → [Ag (NH3) 2] + + Cl -
Комплексообразуващи лиганди, свързани силна връзка и дисоциация на комплекса йон се появява в по-малка степен. Този тип дисоциация се нарича вторичната.
Мярка за стабилността на комплекс йон е неговата нестабилност постоянна и обозначен с Кн.
Колкото по-малко постоянен нестабилност, толкова по-стабилен комплекс.
Комплексни съединения играят важна роля в процесите на живота на растенията и животните. комплексни съединения изпълняват различни функции в тялото на животни и растения: натрупването и движението на различни вещества и енергия; формирането и разцепването на химични връзки; участие в процесите на дишане, фотосинтеза, биологично окисляване и ензимна катализа. Такива биологично важни вещества като хемоглобин, хлорофил, tsiankobolamin са хелатни, хелатни съединения. В тези четири координационни места заети от една частица, наречена порфин, комплексообразуващ агент на хемоглобина е - Fe 2. и хлорофил - Mg 2. витамин В12 - Co 3.
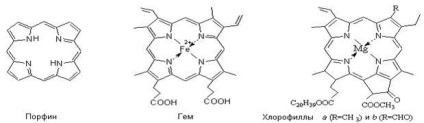
Порфирин железен комплекс е с равнинна структура, където железен йон е свързан координационни връзки с 4 пиролови пръстени 4, 5 са в комуникация присъединяване глобин протеин, но в шеста координация сфера свободно. Това отнема и кислород молекула, носена от хемоглобин в процеса на дишане.
Наскоро открихме, че комплекси на платина и паладий имат инхибиторен ефект върху развитието на злокачествени тумори и могат да се използват успешно за терапевтични цели, хелатиращ (хелатни) съединения се използват солите разтваряне в камъни в бъбреците и намаляване на твърдостта на водата, поради присъствието на калциеви йони и магнезий. Известен висока бактерицидна активност на някои комплексни съединения на среброто. Трилон B (EDTA) могат да образуват комплекси с много метали включително Са +2. Това позволява използването му при заболявания придружени от прекомерно отлагане на калциеви соли в тялото.
Свързани статии
