CTLA-4: как да се направи на имунната система, за да убие раковите клетки
Първата група от кандидати, които нарича Thomson Reuters, включени Джеймс Елисън, Джефри Bluestone и Крейг Томпсън. Джеймс Алисън е посветена на борбата с рака през целия си живот. Изследвания, при които е участвал, са революция в лечението на рак. Той се превръща в един от пионерите в използването на естествен имунитет за борба с раковите клетки.
По-голямата част от живота на клетките на имунната система, лимфоцитите, извършена в проучването. Някои от тях водят живот на жителите във вътрешните органи, от друга страна постоянно се движи през кръвоносната система. За включване на разузнавачите в войници, или обратно, на Т-лимфоцити необходимо химичен сигнал. Част от Т-лимфоцити се активира, когато се среща с потенциален враг, но в началото на деветдесетте години, стана ясно на учените, които са важни и други механизми за стимулиране. Допълнителни сигнали хранени лимфоцити, мембрана рецепторни протеини. Някои от тях са принудени да се справят с лимфоцитите антитела и други, напротив, деактивирането и дори да го унищожи. Към днешна дата има три основни протеин деактиватор лимфоцити: PD-1, CTLA-4 и TIM-3. Протеините, които премахват левкоцити от провал, не по-малко важно от активатора протеин: без имунната система на организма убива дори здрави клетки. Тяхното изследване - е основният фронт на съвременната имунология в онкологията.

Allison създаде лек за рак чрез изследване мембранен протеин на CD28 лимфоцити, които стартират режим "воин", и протеинът CTLA-4, което изключва лимфоцит, го предпазва от унищожаване на клетки.
Голям принос в изучаването на функциите на CD28 и CTLA-4 има Джефри Bluestone и Крейг Томпсън: те се оказа, че тези протеини работят по двойки, а след активиране, деактивиране на лимфоцитите (неговите изследвания се предполага, че тези протеини са отговорни за лимфоцитите дивизия). Откриване на Bluestone Томпсън и колегите бяха изненадани: никой не очакваше, че двете хомоложни протеини ще се държат по различен един от друг.
идея Елисън е да "изключете" - деактивиране на CTLA-4, за да даде възможност да се конкурира рак лимфоцити. предложение на Елисън с голям скептицизъм прието в научната общност, но клинични изследвания са довели до изненадващи резултати: 4 месеца от група пациенти, които са лекувани с инхибитори на CTLA-4, е оцелял повече от 20% от пациентите. В контролната група, а не един оцелял. Медикаменти, разработени от Елисън Research, Bluestone и Томпсън, спасени живота на хиляди хора.
PD-1: как да не се даде на имунната система на почивка
Втората група от биолози, че Томпсън Ройтерс Други Nobel лауреати, също участва в имунната терапия на рак, обаче, вече се използва PD-1 - рецептор, който предизвиква клетъчна смърт процеса programmiruemots.
Всичко започна през осемдесетте години, когато японската биолог Tasuku Хонджо. Неговата работа също е посветена на изследването на протеин PD-1 работа. През осемдесетте години Honjo открити гени, отговорни за синтез на PD-1, и определени неговата роля в тялото: Оказа се, че този протеин е отговорен за апоптоза - процесът на самоунищожение на клетките.
Harvard биолог Gordon Freeman (адаш колега и известен лекар на Half Life), ангажирани в същия протеин рецептори на Т лимфоцити - CTLA-4 и CD28, както и софтуерни механизми на клетъчна смърт и PD-1. В експерименти Freeman миши лимфоцити, които произвеждат много малко PD-1, умират в ранна детска възраст от различни автоимунни заболявания. При липсата на този важен протеин, който, като CTLA-4, деактивира клетки, тяхната имунна система убива всички техни органи и тъкани.
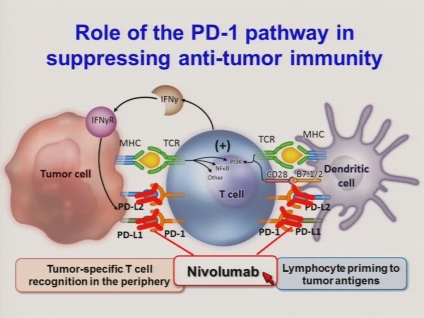
Фрийман е бил в състояние да опише механизма на нейната работа. Комуникацията с подходящ лиганд PD-L1 върху повърхността на лимфоцитите PD, като CTLA-4, деактивира лимфоцити. В допълнение, PD-1 предизвиква апоптоза - програмираната клетъчна смърт. Здраво тяло понякога е необходимо, за да убие собствените си клетки - например, по време на бременността, тялото не се е плод на чуждо тяло, което трябва да бъде унищожен. Механизмът е също започна в автоимунни заболявания, когато тялото, за да оцелее, за да убие прекалено активна имунна система.
Gordon Freeman и Arlene Шарп установено, че раковите клетки са в състояние да използват комплекса PD-L1 / PD-1 за собствените си цели, измама стимулира организма за спиране на имунната система. Почти 15 години, прекарани на разработването на лекарства на базата на антитела, които се свързват с PD-1, и не му позволяват да изпълнява своята функция. Клиничните изпитвания са доказали особено успешни при пациенти с меланом: дългосрочна ремисия се наблюдава при изследване на раковите заболявания за невероятния 40% от пациентите. За други видове лекарства против рак са били малко по-малко, но все още в сила. В много отношения, напредъка в разработването на лекарства инхибитор PD-1 се свързва с щедра решение Фрийман Шарп отвори своя дизайн и патенти за цялата научна общност. Това изискваше много лаборатории по целия свят в застрояване подобни лекарства.
mTOR: как да се спре безконтролното делене на клетките
Всичко започна с това, че в проба от почвата донесени от Великденския остров, те открили бактерия, която произвежда мощен фунгицид. Веществото се нарича рапамицин. Когато се опита да се прилага за лечение на гъбични инфекции при хората, тя установи, че рапамицин може да подтисне имунната система, регулиране на Т-клетъчен жизнен цикъл. Той започва да се използва активно за предотвратяване на автоимунни реакции и на отхвърлянето на органи след трансплантация.
В началото на 90-успели да разберат как рапамицин. Генетични изследвания разкри, че с цел да се рапамицин спря да работи, трябва да се направи на "размисъл", трите гена. транскрипционни продукти на тези гени, наречени "мишена на рапамицин» (Target на рапамицин, ТСР). След три години на обучение в дрожди са завършени, и учените се обърнаха към целта за търсене на рапамицин при бозайниците. Тя се оказа на протеин mTOR.
mTOR работа е фосфорилиране на протеин в начина, по който се синтезират на "клетъчен конвейер" - рибозомата. Чрез добавяне на фосфатна група на атомите на единична аминокиселина ( "изграждащи блокове" на протеин), mTOR е в състояние за по-нататъшно определяне съдбата на протеин, неговото действие или бездействие на клетката. Повечето от протеини, които са отговорни за произведения mTOR процеси на растеж и клетъчното делене, както и клетъчния метаболизъм. Когато mTOR е твърде активен, за да направят своите клетки започват неконтролирано делене - ще се превърне в раков тумор. Сега учените работят върху лекарства - инхибитори на mTOR. Последните развития в тази област имат за цел да се предотврати протеин, получен от една молекула АТФ фосфатна група и по този начин го лиши от способността му да изпълнява основната си задача.
