Безплатни и неподвижни рибозоми: въвеждане на протеини в EPS Редактиране
"Свободен" и "седни" рибозома Редактиране
Ко-транслационно транспортира EPR Редактиране
Транспортни протеини проведени в EPR като техния синтез, като рибозом синтезиране на протеини с сигнална последователност на EPR, "седни" на специфични комплекси на EPR мембранната транслокация.
Сигналната последователност за ESR съдържа обикновено 5-10 за предпочитане хидрофобни аминокиселини и е разположен на N-края на протеина. В своя край, отдалечен от частта има консенсус последователност разпознава от специфична протеаза. Това сигнална последователност се идентифицира специален комплекс - "сигнал идентифицирани частиците» (сигнал за разпознаване на частиците, SRP). Структурата включва шест SRP протеини и къса РНК молекула.
Едно място се свързва сигнална последователност SRP, а другият се свързва с рибозомата и блокове излъчване. SRP отделен домейн, отговорен за свързване с SRP-рецептор на мембраната на EPR.
Заедно с SRP рибозом се движи и комуникира с EPR SRP рецептор (цялостни протеини) на цитозолен страна на EPR на мембраната. Този комплекс (рибозом - SRP - SRP рецептор), свързани с понякога - транслокатор протеин на мембраната на EPR. Обикновено иРНК свързана с няколко рибозоми и polyribosomes EPR мембрана седи, всеки свързан към неговата рибозом порите. Постигането на 3'-края на мРНК, рибозом връща в цитоплазмата, иРНК, но се задържа в мембрана ESR на дължи на факта, че новите рибозом трикотажни с SRP, прикрепен към неговата 5'-край.
След свързване към комплекса от SRP транслокатор - SRP рецептора се отделя от рибозомата, и това води до възобновяване на предаването. Сега е доказано, че превода на протеин, както EPR прониква през транслокатор вода канал с механизъм стробиране в еукариоти и образуван от четири субединици сложни Sec61 (хомоложни протеини имат на бактериални клетъчни мембрани).
При възобновяване на предаването хидрофобен регион на сигналната последователност е свързана с транслокатор и новосинтезираната протеин под формата на примка се избутва в EAF. Този процес не изисква допълнителни разходи за енергия на АТФ. След С-края на протеина се отделя от рибозомите и е вътре EPR сигнален пептид протеаза го отрязва от протеина. Протеин в ESR е сведена до минимум чрез придобиване на нормалната структура, а сигналният пептид чрез страничен канал отвори в транслокатор се премества в мембрана EPR липидния двоен слой, където протеази бързо унищожени.
Уловени в EPR е протеин в органела, ако има специална "стопанство в EPR» (ER Запазваща) последователност на четири аминокиселини при С-края. Някои от останалите EPR протеини играят важна роля в нагъването и пост-транслационна модификация на протеини, преминаващи през EPR. Така ензим дисулфид изомераза катализира окислението на свободни SH-групи на цистеин и образуването на дисулфидни връзки в протеин на шаперон BiP предотвратява неправилното нагъване и агрегиране на протеини за образуване на четвъртични структури, както и насърчава задържане на протеините, свързани с ESR.
Вмъкване на мембранни протеини в EPR Edit
Подобна, но по-сложен механизъм осигурява ко-транслационния включване на трансмембранни протеини в мембраната на EPR.
Посттрансланционни транспорт на EPR Редактиране
Има и транспорт протеин posttranlyatsionny в EPR (по-често в дрожди), при което напълно се синтезира протеин се свързва с чаперони в цитозола и след това се прехвърлят в EPR чрез транслокатор включващи Hsp70 семейство чаперони. Този вид транспорт е АТФ-зависим. За транспорт пептиди (дължина за предпочитане 8-16 амино киселини) от цитозола на EPR за последващо представяне в комплекс с молекули МНС-I има специален транслокатор - TAP-протеин.
Протеин транспорт от апарата на Голджи EPS в Edit
Протеин идва от EPR AG граничи вътре мембранни везикули, черупката на което се образува от COP-II протеин. Всички точно нагънати протеини попадат в тези мехурчета "по подразбиране", и преместени във AG, и след това някои от тях се върна на EPR. Въпреки това, протеини със специален предупредителни етикети са съсредоточени в мехурчетата транспорт и протеини без такива етикети на едно място в малки количества. EPR отделя от мехурчета, черупки нуждаещите се сливат в тръбните-везикуларен клъстери, които посредством мотор протеини се движат по микротубулите на AG. От тези клъстери (например от цис-Golgi) разделят мехурчета облечени протеин COP-I, да осигури връщането транспортни протеини пребиваващи в EPR. Назад протеини в EPR е осигурен кратко сигнална последователност в техния С-край, който се свързва директно COP-I (за мембранни протеини), или на специфичен рецептор, който взаимодейства с COP-I (за разтворими протеини). Лишени от тези последователности са благоприятно протеини в хипертония.
Протеините в рамките на мехурчета постепенно се премества от цис-Golgi към транс Golgi. Както протеините движат anutri AG гликозилтрансфераза ензими носят модификация на "етикети" олигозахаридните. С помощта на тези ензими в синтезата на гликопротеини AG - муцини и протеогликани.
Основната функция на апарата на Голджи - сортиране на протеини Edit
Транспорт на протеини, за да лизозоми Редактиране
Транспорт на протеини към лизозомите AG Edit
Мембранни протеини на лизозомите и храносмилателни ензими са от транс-Голджи състои граничи клатринови мехурчета в началото на ендозома, и от там - в лизозома. За въвеждане на лизозомни ензими (кисели хидролази) в лизозоми те трябва prisutsvovvat специална марка - остатъци от маноза-6-фосфат края на олигозахаридните вериги. Този етикет се прилага на два етапа. Първо, в ензима цис-Golgi N-atsetilglyukozaminfosfotransferaza придава на олигозахариди остатъци N-atsetilglyukozaminfosfata, и след това в транс-Голджи втория ензим разцепва N-ацетилглюкозамин. Етикетът се прилага към тези протеини, които имат специфични характеристики на третична структура - "сигнал бум» (сигнал пластир). След това, маноза-6-фосфат, са идентифицирани специфичен мембранен рецептор свързани чрез хидролаза. РН на ендозомите се понижава хидролаза отделя от рецептори, които в специални мехурчета доставени обратно и хипертония.
Мутации на ген N-atsetilglyukozaminfosfotransferazy резултат на тежки мукополизахаридоза на - I-клетъчна болест, където всички лизозомни ензими се секретират в извънклетъчната среда.
Транспорт на протеини от външната среда, за да лизозомата Редактиране
Дори и в нормалната част на лизозомни ензими, освободени от клетки в рамките на лизозомни мембранни протеини пада върху външната мембрана. От извънклетъчната среда лизозомни ензими може да се абсорбира от ендоцитоза и транспортирани до лизозома (вж. [2]).
Транспорт на протеини от цитоплазмата към лизозомата Редактиране
Освен везикуларен транспорт на хипертония, има и друг начин на транспорт на протеини в лизозома. Така, в шаперон-медиирана автофагия насочено транспорт настъпва частично денатурирани протеини от цитоплазмата чрез лизозом мембраната в неговата кухина, където те се смилат. Този тип автофагия описано само бозайници индуцирани стрес. Той се среща с участието на цитоплазмени хаперонови протеини HSP-70 семейството, спомагателни протеини и LAMP-2, което е рецепторен комплекс мембрана и протеин на шаперон да транспорт в лизозома. антиген-представящи клетки (например, дендритни клетки) пептид транспортни prezentiruemyh комплекс с МНС-II, могат да се появят директно протеин TAPL на лизозом чрез-транслокатор.
Транспортни протеини в ядрото на клетката и ядрото на Edit
основни протеини получите чрез ядрените пори. Чрез ядрено порите може да бъде едновременно транспортира до 500 макромолекули в двете посоки. Протеини (пептиди) с молекулно тегло от 5000 далтона до свободно дифундират през ядрените порите (така че тяхната концентрация в същото цитоплазмата и в ядрото). Чрез пасивен транспорт (дифузия) могат да проникнат през порите на протеини с молекулно тегло до 60000 далтона.
От по-големи протеини към ядрото като включва само сигналната последователност на сърцевината (един или два кратко част на протеин, богат на положително заредени аминокиселинни остатъци - аргинин или лизин). свързват специфични протеини с тази последователност - рецептори внасят в ядрото (понякога с допълнителни адапторни протеини). Внос рецептори към ядрото и да се свързва компоненти на енергично дълго. Тя осигурява енергия за транспорт GTP хидролиза, проведени малки мономерни GTPase основи - Ран-протеини. Цитоплазмата Ран-протеин се свързва с форма БВП, както в цитоплазмата локализиран Ран-GAP протеини (протеини активатори GTPase Ран активност), и в ядрото Ран-протеин е свързана с GTP форма, както в сърцевината локализиран протеин, осигурява обмен БВП GTP. Ран-GTP свързване на вътрешността на порите с енергично "натоварени" внос рецептора към ядрото, осигурява преминаването му в ядрото и разтоварване. След това, с приложените рецепторни Ран-GTP изходите в цитоплазмата, където протеин GAP-GTP причинява хидролиза и разделяне Ран БВП внос рецептор в ядрото.
Подобен механизъм позволява износа на протеини от ядрото, само тези протеини трябва да имат различен сигнална последователност, които се свързват с рецептори износ от ядрото (протеини, подобни по структура на внасят рецептори).
Този въпрос се разглежда в рамките на ядрени порите
Протеин транспорт от апарата на Голджи към външната мембрана Edit
Протеини, вградени в мембраната на EPS и излезе от там като част от везикули в хипертония, може да се премества към външната страна на клетъчната мембрана. Тяхната посока се извършва за везикулите мембранните чрез взаимодействие с микротубулите цитоскелет и благодарение на специални докинг протеини, които осигуряват сливане на везикули на мембраната.
Секреторния функция на Golgi апарат редактира
Ендоцитозата: фагоцитоза и поноцитоза Редактиране
[1] - пиноцитоза анимация (например, абсорбция на холестерола в LDL sotave) (angl.tekst)
Екзоцитоза и трансцитоза Редактиране
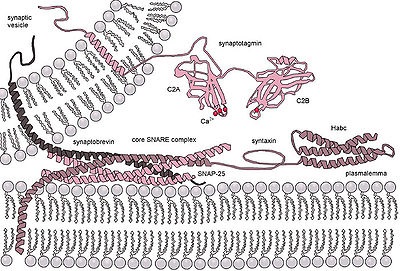
Молекулно машина ekzotsitoznogo освобождаване на невротрансмитери в синапса. комплекс SNARE се формира поради образуването на теглича теглене между chetyrohspiralnoy синаптобревин. синтаксин и SNAP-25. Synaptotagmin е калциев сензор и комплекс образуването на вътрешния регулатор протеин
Екзоцитоза е, както при еукариотите, прокариоти така UY. Екзоцитоза (от гръцката Έξω -. Керамика и κύτος - клетки) в еукариоти - клетъчен процес, при който вътреклетъчни везикули (мембранни везикули) се сливат с външната клетъчна мембрана. Когато съдържанието на секреторен везикули екзоцитоза (ekzotsitoznyh мехурчета) екскретират и техните мембранни предпазители с клетъчната мембрана. Почти всички макромолекули (протеини, пептидни хормони и т.н.) са извлечени от еукариотни клетки чрез този метод.
В прокариоти не е намерена механизъм везикуларен екзоцитоза, те се наричат екзоцитоза вграждането на протеини в клетъчната мембрана (или на външната мембрана на грам-отрицателни бактерии), разделяне на протеини от клетките в околната среда или в периплазменото пространство [1].
Екзоцитоза може да изпълнява различни задачи:
- доставка към клетъчната мембрана липиди, необходими за клетъчния растеж;
- доставка към клетъчната мембрана на мембранни протеини. като рецептори или протеини транспортьори. В тази част на протеина, която е насочена в секреторни везикули, се проектиране върху външната повърхност на клетката;
- избор на различни вещества от клетките; тя може да бъде, например, хаотичен храна в fagotrofnyh протисти, храносмилателни ензими в животни с кухинна храносмилането, протеини междуклетъчното вещество в животни и клетъчна стена материал в растения, сигнални молекули (хормони или невротрансмитери).
При еукариотите, има два вида екзоцитоза:
- Калциев -независимо конститутивна екзоцитоза среща в почти всички еукариотни клетки. Това е необходим процес за изграждане на екстрацелуларни матриксни протеини и доставката на външната клетъчна мембрана. Така секреторни везикули се доставят към клетъчната повърхност, и предпазител с външната мембрана, тъй като те са оформени.
- Калциево-зависимо nekonstitutivny екзоцитоза се случи, например, в химическата w: синапси или клетки, произвеждащи макромолекулни хормони и служи, например, за изолиране на невротрансмитери. При този тип екзоцитоза на секреторни везикули се натрупват в клетката, и процеса на тяхното освобождаване се задейства от специфичен сигнал медиирана бързо повишаване на концентрацията на калциеви йони в цитозола на клетките. Процесът на пресинаптичното мембрана осъществява чрез специален калций-зависима протеин комплекс [w: [SNARE |]].
Интраклетъчна храносмилането Редактиране
вътреклетъчната храносмилането механизъм Редактиране
Ролята на вътреклетъчния храносмилането за правата на животните
Автофагия и неговата роля Редактиране
Автофагия (от старогръцката αὐτός -. Сама по себе си и φαγεῖν - «е»), «samopozhiranie" - процес, при който клетъчните компоненти се доставят в нея и да преминат лизозомно разграждане в тях.
Сега има три вида автофагия - mikroautofagiyu, макроавтофагия и придружител зависими автофагия.
Когато mikroautofagii като в образуването на мултивезикуларни тела образуват мембранни инвагинация ендозоми или лизозоми, които след това се отделят под формата на вътрешни везикули, те само попадат вещества синтезирани в самата клетка. По този начин клетката може да се извари протеини при недостиг на енергия или строителен материал (например, на гладно). Но mikroautofagii процеси се случват при нормални условия и по принцип не-селективност. Понякога по време на mikroautofagii усвоява и органели; така в дрожди е описано mikroautofagiya пероксизомите и частични mikroautofagiya ядра, в която клетките остават жизнеспособни.
Когато макроавтофагия цитоплазмен участък (често съдържа всеки органели) околното мембранни отделения като ендоплазмен ретикулум резервоар. В резултат на тази част е отделена от останалата част от цитоплазмата две мембрани. Такива dvuhmembrannye органели околните изтрити органели и цитоплазма се наричат autophagosomes. Autophagosomes свързани с лизозоми. формиране autofagolizosomy в която органели и друго съдържание autophagosome смилат.
Очевидно, макроавтофагия също безразборно, въпреки че често се подчертае, че с помощта на това клетката може да се отърве от "излишно" органели (митохондрии. Рибозоми, и т.н.).
Третият тип автофагия - шаперон-медиирана. В този процес, насочен транспорт настъпва частично денатурирани протеини от цитоплазмата чрез лизозом мембраната в неговата кухина, където те се смилат. Този тип автофагия описано само бозайници индуцирани стрес. Той се среща с участието на цитоплазмени протеини шаперон семейството HSC-70, спомагателни протеини и LAMP-2. който служи като рецептор комплекс мембрана и протеин на шаперон да транспорт в лизозома.
Когато видът на autophagic клетъчна смърт усвоява всички клетъчни органели, като остават само клетка отломки. абсорбира от макрофагите.
Патология в нарушение на правилата на вътреклетъчния храносмилането
Клетките и междуклетъчното вещество Редактиране
Образуването и състава на междуклетъчното вещество Edit
клетка взаимодействие с междуклетъчното вещество Edit
Свързани статии
