Катализ (от гръцки katalysis -. Унищожение), скоростта на промяна на химическо вещество. р-процедура при излагане на правомерно (катализатори), притежавани до участвал в р-нето, но не са част от продуктите. Катализаторът не е в стехиометрично. отношения с храна и регенерира след обърна всеки цикъл. реагенти за продукти. Разграничаване К. положителни и отрицателни в зависимост от това дали катализаторът ускорява р-ТА или забавя. Като правило, терминът "К." се отнася до ускорение р-ТА; на островите, забавя р-ТА, наречена. инхибитори. Katalitich. ефект върху р-нето може да се образува в м.с. на р-ТА. Острови или в продукти (вж. Автокатализ) .За К. характеристика, че малък брой катализатор ускорява преобразува. голям брой на взаимодействие в инча Например, 1 тегл. ч. Pt катализатор се превръща. Април 10 тегловни. ч. SO3 в SO2 или 10 6 тегл. ч. NH3 да NO. В ускоряващ ефект на р-erator ЛИЗАЦИЯ на Rah р-в-р обикновено не се счита за К., на основание, че броят на р-erator обикновено значително надвишава броя на взаимодействие на разтворен-ин. Известен обаче случаи на ускорение р-ции в присъствие. много малки допълнения на р-erator напр. вода. Неизменност на химичното вещество. състав и структура на катализатора при завършване на процеса едва ли може да служи като задължително функция на К. Известно е, че химически. състав катализатор изпуска от реактора е по същество различно от тези натоварени; от състава и структурата на състава на катализатора влияе на реакцията. смес. Неизменност на химичното вещество. състав и структура на катализатора има смисъл да се разглежда във връзка с този на елементарни стъпки katalitich комплекс. р-ТА, в рояк-катализатор е пряко ангажиран, но за това е необходимо да се създаде механизъм, сигурно р-ТА, което не винаги е възможно. Терминът "К." I. Берцелиус въведена през 1835 г. В хомогенна катализа на катализатора и взаимодействие на островите са в една и съща фаза в състояние молекулна дисперсия. В хетерогенен катализ, катализаторът образува самостоятелно паркиране. фаза отделена от фазата на раздел граница в рояк са взаимодействие на островите. Изолирани хомогенна и хетерогенна К. при ром р-ТА започва от твърд катализатор превръзка-STI, и след това продължаване на обема. Междуфазово катализа нарича K на границата на две несъвместими течности; където катализаторът е да се прехвърлят реагенти между фазите. Сплит. позиция между хомогенна и хетерогенна К. К. се microheterogeneous колоидни частици в течна фаза. Ускоряване на р-ции в присъствие. мицел повърхностно активно вещество, наречено. мицеларен катализа. Решаваща роля в процесите в живите организми играе ензимна катализа, поради действието на ензими. Важен компонент на бала. катализатори са промотори - на островите, като към катализатор-ryh малък брой острови (процент или част от процента) увеличава неговата активност. селективност или стабилност. Ако промоторът се прибавя към катализатора в голям брой острови или се каталитично активен катализатор наречен. смесена. Островите, на въздействие-ryh върху катализатора води до намаляване на дейността си или пълно спиране katalitich. действие се нарича. каталитични отрови. Има случаи, когато същата добавка на катализатора при някои концентрации и т-Rah е промотор, в други - отрова. В heterog. К. медии широко използвани - по островите се каталитично неактивен или ниска. Прилагането им катализатора значително подобрява дейността си. Гл. Пр. поради увеличаване на превръзка-STI катализатор или превенция на частиците чрез синтероване (вж. Поддържаните катализатори).
Общи закономерности на катализа. Всички katalitich. р-ТА -samoproizvolnye процеси, т.е.. е. в посоката на потока на енергия изтощение система Гибс. Катализаторът не превключва позиция химически равновесие. р-ТА, с изключение на неговия ефект върху фактор. активност при взаимодействие на (нестабилност или фактор., в случай на р-ции в газова фаза при високи налягания) р-в-ма. Близо до равновесие същия катализатор ускорява напред и р-ТА обратен еднакво далеч от равновесие не може да бъде. От няколко. възможно р-ции катализатор не ускорява непременно термодинамично naib. Най-добрият, т. е. това, за което е намаляването на броя на Гибс енергия е максимална. Напр. в присъствието. Bi2 О3 .MoO3 пропилей частично окислен (до акролеин) в присъствието. Co 3 О 4 има пълно окисляване (за CO 2 и Н 2О). Мярка за селективност (селективност на действие) на катализатора е съотношението на процента 1/2 O2. . MO 2) N 2 + MO М + Н 2О К. процес една стъпка (който се нарича също асоциативен или конфлуентни) процедира съгласно схемата: A + K * AC. В + С В този случай (крива 2 на фиг.), Катализаторът не образува стабилна междинно съединение. Кон. реагенти, но е включен в активирането. комплекс AK *. P-ТА се извършва с преодоляване на потенциалната бариера между началните и крайните състояния на системата като nekatalitich. р-ТА, но с намалено активиране енергийна стойност (Е4 на фиг.). Висока katalitich скорост. р-ТА т. б. Това не само, причинени намаляване на активиращата енергия на потока поради р-ТА на новия механизъм, но изпълнението на катализатор под действието на механизма верига р-нето. Напр. katalitich. ефект на водна пара на окисление в газова фаза на СО поради реакцията на образуване. вериги, включващи активно видове Н и ОН. В хетерогенно хомогенно. К. за обличане-STI образуват активни частици (напр. Безплатно. NO 2 радикали и RO2 в окисление на въглеводороди RH), притежавани до тогава изхвърлени в газова фаза, и продължават веригата.
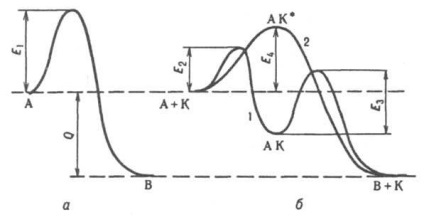
Енергийният диаграма от тип А. В реакция; и - без катализатор, б - с катализатор К; 1 - когато механизмът за полагане, 2 - ако асоциативен механизма на катализа: Е1. E2, E4. Е4 потенциални бариери разделящи първоначалното и крайното състояние на системата, Q - топлина ефект на р-ТА.
Оказа образуването на вериги на катализатор превръзка-STI в полимеризацията на олефини и синтез на въглеводороди от СО и Н2 за множествено число. друг хетерогенен katalitich. р-ции открити Характеристика характеристика за верига р-ции: генериране на активните сайтове (нанасяне на ивици пълнене места на превръзка-STI и тяхното освобождаване), образуването на активното междинно съединение. частици superequilibrium концентрации (като по този начин за преодоляване на бариерата енергично неблагоприятни стъпки), постигането макс. скорост р-ТА след определен период от време-Roe след неговото начало. Katalitich. верига и р-ТА носи кинетична явление. спрежение. Ако преобразува. катализатор във взаимодействието. Реагент се ангажира katalitich. р-ТА (т. е. имат обща межд. количество или активиран. комплекс), става възможно да се образуват супер равновесните концентрации на активни сайтове на катализатор превръзка-STI и др. Ефекти типични верига процеси.
Основните механизми на катализа. Katalitich. процеси, дължащи се на електронен трансфер (окисление, редукция. хидрогениране, дехидрогениране. разграждане на нестабилни кислородни съединения), посочени като редокси катализа. Типични катализатори за това са преходни метали и техните съединение. Обикновено оксиди (V2 О5 МпО 2 МоОз 3 CR2 O 3..), Шпинел (Fe3 O4 CuCr2 O4.), Сулфиди (MoS2 WS2.) И др.; р-ции в р-Pax - соли и комплекс порт. преходни метали. Висока katalitich. Активност в тези в дължи на факта, че преходни метални атоми, могат да съществуват декември окисление, промяна в-ryh не изисква голям energetich. разходи. В резултат на електронен трансфер от реактива към катализатора е по-лесно, отколкото в отсъствието на катализатор от редуктор с окислителя. Когато преход Своб един електрон образува. радикали участват по-нататък в р-нето. Напр. при прехода от един електрон от активния център на молибден катализатор за кислород образува йон радикал O 2 участват допълнително в katalitich. окисляване (Mo + 5+ Mo 6+ 2О + O 2О 2 + С пН m продукт.). Има okislit.-възстановяване. К. много-електрон механизъм, с ром не образуват БЕЗПЛАТНО. радикали като междинно съединение. частици. Multielectron преходи между катализатора и реагиращи молекули са възможни, ако активното място на катализатор включва няколко. преходен метал атома. Напр. в разлагането на Н 2О 2 комплекс активно съединение. 2, съдържаща йон Fe3 +; за възстановяване на мол. азот N2 Н4 - комплекс съединение. съдържащ 2 или повече йони V 2+. Чрез процеса на киселина-основа катализа са katalitich. напукване. хидратация, обезводняване. пл. р-ТА изомеризация, кондензация Org. в-ин. Типични катализатори за този клас процеси - на островите, могат да предават или получават протон от реагенти способни или geterolitich. взаимодействие. реагент (без разделяне на електронната двойка). Сред тях по-а - протон (H 2SO 4 СН3 СООН, СН.) Или апротонен (BF3 AlCl3.) До вас, аморфна и кристална. алумо-силикати. Al2 О 3. фосфати, сулфати. Активните центрове в техния център е протон Н + (Йоханес Брьонстед център) или електронна двойка акцептор, например. Al атом (Lewis център). По-рядко се използва основен катализатор (разтворен база, твърдо вещество СаО, MgO, и т.н.). Когато m. Наречен. полифункционални катализатори katalitich сложни отделни стъпки. процеси okislit. намаляване и алкално-киселинното - се провеждат в различни съставни части на многокомпонентни многофазни системи. Напр. от непълното окисление на ненаситени алдехиди до ненаситена-ви в присъствие. Мо окис и V в началното събитие настъпи okislit.-възстановяване. катализатор превръщане:
Химическа енциклопедия. - М. съветски енциклопедия. Ед. IL Knunyants. 1988 година.
Свързани статии
