Каталитични процеси НА СИНТЕЗ на органохлорни (II част)
процеси оксихлориране,
Каталитични процеси оксихлориране на наситени и ненаситени въглеводороди с С1-С3, които са основната област на използване на хлороводород и определяне на хлора на равновесие. Анализирахме кинетични модели и технологичните процеси за производство на хлорометан, дихлоретан и винилхлорид, алилхлорид. Начини специалистите органохлорни преработка на отпадъци метод оксихлориране и хидрогениране гарантира пълно използване на въглеводородната суровина.

Схема I. Конюгиране окислителната реакция на хлороводород
на заместителна реакция хлориране на наситени въглеводороди:
Схема II. Конюгиране реакции (1) и (2) от реакционна схема I реакция на дехидрохлориране ограничаващи хлорирани въглеводороди.
Схема III. Реакция свързване оксихлориране на ненаситени въглеводороди.
Схема IV. Заместването реакция на окислително хлориране на ненаситени въглеводороди.
Като се има предвид също и страничните реакции на дълбоко окисление до моно- и въглероден диоксид, може да се заключи, че окислително хлориране на въглеводороди е сложни условия на процеса многопътност, които трябва да бъдат избрани в зависимост от задачата.
В основата на процеса на оксихлориране служи като реакция в газова фаза на хлороводород окисляване отворен Deacon през 1868.
Окислението на хлороводород до хлор - обратима реакция, която се проявява обикновено при температура от около 0 ° С 400 Зависимостта на равновесната константа на температура е [4]:
Стойностите Кр и степента на О2 и HCl превръщане значително намалява с увеличаване на температурата на процеса. Увеличаването на излишък на кислород, и повишаването на налягането води до повишаване на степента на превръщане на солна киселина и Cl2 съдържание в реакционната смес, но температури в интервала от 600-700K, когато скоростта на процес е достатъчно висока, равновесие HCl преобразуване достига 90%.
Когато се комбинират дякон поток реакции (1) и хлориране (2) (2 1) равновесие реакционната измества поради консумацията на хлор, при което може да има почти пълно превръщане на HCI. Поради тази причина, всички реакцията на оксихлориране на алкани, алкени и тяхното хлориран практически необратимо в работния обхват на температури [5].
Общоприето е гледна точка, съгласно който в висока температура окисляване на HCl и оксихлориране каталитично активни компоненти обикновено е смес от меден хлорид и алкалоземни елементи са на повърхността на носителя в стопено състояние. Появата на меден хлорид, както при въвеждането на хлориди на алкални метали, води до намаляване на евтектични сплави топене използват катализатори.
Въз основа на схемата за общо Deacon реакция е предложено и адсорбционни кинетични проучвания hlormednyh катализатори в присъствие на [3, 6, 7]:
Тази диаграма съответства на следната кинетичната уравнение:
където К - Константа на равновесие на термично разпадане на меден хлорид;
к - постоянна скорост кислород адсорбция.
Получените данни са използвани за изследване модели на оксихлориране на наситени въглеводороди - метан и етан.
HCl окисление в присъствието на постъпления метан съгласно кинетичните закони, установени за процеса на Deacon, т.е. независимо от наличието в реакционната смес от хлорометан. Друга особеност е идентифициран сходство кинетиката на образуване на хлорометан в оксихлориране реакции и директно хлориране, в присъствието на CuCl 2 -KCl система. И двете реакции се характеризират с първи ред кинетична метан, фракционна хлор и практически идентични стойности на енергията на активиране (113 кДж / мол). Скорост на оксихлориране и хлориране може да се опише чрез уравнението на силата на формата, където редът на кислород варира от 0 до 0,25 [3, 8, 9].
Окисляването е солна киселина в целия обем на стопилката върху катализатора, докато реакцията на хлориране на метан и хлорометан, и тяхното окисляване - върху повърхността на стопилката. Освен това тези реакции се срещат в различни активни сайтове, и присъствието на преходен метален катион, в центровете за които не се изисква хлориране. Хлориране взаимодействие на метан до 425 0 С настъпва предимно чрез хетерогенно механизъм, докато при по-високи температури, преобладаващи може да бъде хетерогенно механизъм хомогенна прекратяване квадратичен верига с хлор.
Технологичният процес на оксихлориране на клирънс метан може да бъде различна, като се използва кипящ слой или неподвижен слой. Комбинацията от двете изпълнения, предлагайки ефективно отвеждане на топлината, и висока конверсия на изходни материали.
Някои перспективи представляват възможност за промишлено изпълнение на процеса на оксихлориране на етан за да се получи желаният продукт директно - винил хлорид. Пикът на научните изследвания в тази посока дойде през 70-ти - 80-ти години на ХХ век и е бил изпълнен със значително ниска цена на природния газ в сравнение с необичайно високи цени на петрола на суровини през периода.
От научни и прилагане становища интерес geterogennokatalitichesky, газова фаза процес за окислително хлориране на етан. Процесът се извършва в присъствието на конвенционални катализатори Deacon - меден хлорид с добавки върху инертен носител. В зависимост от условията на процеса на образуването на широк диапазон от хлорирани производни на етан и етилен. За преференциално образуването на винил хлорид се предпочита висока температура от 400-550 0 ° С
Както в окислително хлориране на метан, образуване на хлор и последващите процеси хлориране появят в различни активни сайтове. На окислително хлориране на етан и хлорни производни на етан-етилен серия е сложен хетерогенен-хомогенен процес процедура чрез множество паралелни последователни стъпки на хлориране дехидрохлориране, и е последвано от дехлориране реакции на дълбоко окисление на изходните материали и междинни съединения. Общата схема на реализациите на етан е както следва [10]:
хомогенно хомогенно хетерогенна хетерогенно
хомогенно ↓ ↑ хомогенно
При провеждане на процеса при температура от 0 ° С 500-550 основни продукти са етилен и винил хлорид, общ добив достигне 80% [11]. Скоростта на намаляване на етан не HCl зависи от парциалното налягане и е добре описано от следното уравнение [12]:
По подобен начин се подчинява на закони и загуба на скорост хлорирани метан с изключение на 1,1-дихлоретан.
В процеса на оксихлориране на етан се срещат като странични реакции на окисление на хлорирани въглеводороди и да образуват въглеродни оксиди. Скоростта на окисляване е описан от уравнението:
Основен принос за скоростта на образуване на дълбоки окислителни продукти допринесе ненаситен съединение [13]; където приложение на един хлорен атом в молекулата драстично (7-8 пъти) увеличава скоростта на окисление. Освен това увеличение на размера на хлорни атоми намалява добива на СОХ продукти: три- и тетрахлороетан същество не окислява при условията на процеса. Най-добрите технологичните показатели, постигнати по метода използват катализатори CuCl2 -KCl / носител, специфичната повърхност не трябва да надвишава 10 m 2 / г. Селективност процес винилхлорид е 35-40% на превръщане на етан
95% [14]. В тези стойности превръщането на реагентите и в присъствието на водна пара (един от продуктите на процеса) се осъществява вторична конверсия: възстановяване на винилхлорид с етилен и ацетилен с въглероден окис.
Въпреки дълбоката научно и технологично разработване процеси окислително хлориране на метан и етан в промишлени условия, все още не са изпълнени.
Причината за това са високите капиталови инвестиции в комбинация с намаленото търсене в хлорметан (отделяне на въглероден тетрахлорид като цяло са забранени от Монреалския протокол от 1987 г.). Директно превръщане на етан да образуват винил хлорид, последвано от Ьóнг по-голямо количество на отпадъците в сравнение с процеса "етилен". Той играе роля също да бólshaya наличие на суровини за производство на етилен (бензин, дизелово гориво) за европейските страни.
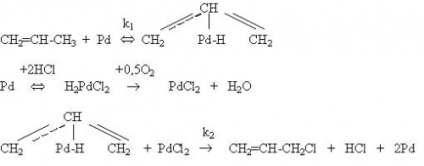
От оксихлориране процеси най-практическо значение окислително хлориране на етилен до 1,2-дихлоретан произвежда като ключов производството на стъпка базирана верига винил хлорид. окислително хлориране на етилен на постъпленията на катализатори, съдържащи CuCl2. при значително по-ниски (200-3000S) температури от процеси Deacon или оксихлориране на наситени въглеводороди, и не включва етап на окисление HCl. Механизмът включва оксихлориране на етилен стъпка реакция с CuCl2. в който се формира редуцираната форма на мед:
Cl Cl Cl Cl Cl ClC2 Н4 Cl Cl / / / / Cu Cu Cu Cu (1а) (1) - Al - О - Al - О - Al - + С2 Н4 ® - Al - О - Al - О - Al - ® | | | | | | Cl Cl | | Cu Cu (1с) ® - Al - О - Al - О - Al - + С2 Н4 Cl2 (1) | | | Cl Cl Cl O Cl | | / / (I) Cu Cu Cu Cu (1с), (2а) - Al - О - Al - О - Al - + Уг O2 ® - Al - О - Al - О - Al - (2) | | | | | | Cl О Cl Cl Cl Cl Cl / / / / Cu Cu Cu Cu (2а) (1а) - Al - О - Al - О - Al - + 2HCl ® - Al - О - Al - О - Al - + Н2 О ( 3) | | | | | |
Заедно с мед в катализатори окислително хлориране на етилен може да бъде въведен като промотори или стабилизатори, метални хлориди като лантан, магнезий, калий и други. Това от една страна, увеличава способността на катионите на мед за координацията свързване с олефини, от друга страна, може да се намали съотношението на странични реакции, по-специално, дълбоко реакции на окисляване [15, c.79].
Странични продукти по време на окислително хлориране на етилен могат да бъдат разделени в две групи:
1. Страничните органохлорни продукти, които включват най-хлор-заместена С1-С2 въглеводороди като парафин и олефин серия;
2. дълбоки окислителни продукти - СО и СО2.
Като се има предвид, че делът на въглерод оксид до 70% от етилена се превръща в странични продукти, за изследване на условията на тяхното образуване е важно приложение. Показани [23], че скоростта на образуване на СОХ продукти е описан от уравнението на тип:
където I - етилен или дихлороетан, скоростта на окисляване дихлороетан приблизително два пъти скоростта на окисление на етилен.
Окисление и етилен дихлорид се случва най-вече в активните центрове, съдържащи CuCl2 фаза и Cu2 (ОН) 3 CI, излишък спрямо взаимодействието с носителя [24,25]. Като активни форми на мед като активни сайтове дълбоки реакции на окисление, се смята, че в схема (I) форма мед преоксидацията чрез реакция (2) координативно свързан към носител, той окислява органичен субстрат. Окислителната реакция се конкурира с реакция (1) по-горе схема, която обяснява HCl инхибиране роля в окислителни реакции.
Общата схема на въглеродни окиси в процеса е както следва
[23]: C 4 H 2 → СН2 ClCH 2 Cl → CH 2 3 ClCHO → ССЦ СНО I II III SO 2 ↓ CO
Съотношението на скоростта на трасетата на образование продукти CO х r1. R2. R3 = 1: 2: 0.3
Данните, получени от изследването на структурата на катализатор и неговото въздействие върху кинетичните параметри на процеса и бяха използвани за разработване на промишлен процес на окислително хлориране на етилен.
Всички процеси окислително хлориране на етилен могат да бъдат разделени в две основни характеристики: използването на атмосферен кислород или чист кислород и използването на кипящ слой или неподвижен слой. Таблица 1 показва характеристиките на най-важните промишлени процеси оксихлориране.
Таблица 1. Характеристики на процеси промишлени оксихлориране.
производителност алилхлорид може да се представи с уравнението:
Катализатори също играят важна роля при прилагането на принципа на балансиране на процесите на захранваща смес от въглеводороди. Най-обещаващите е да осигури промишлени процеси оксихлориране хлоровъглеводороди С2 - С3 до получаване на три- и перхлоретилен и тяхното селективно хидрогениране до получаване на етилен и пропилей, съответно, и връщането им в производствения цикъл.
Оксихлориране хлориран С2 - С3 се извършва в присъствието на смес от мед и калиеви хлориди, се отлага върху порьозен носител. За предпочитане е използването на носители с ниска специфична повърхност (10-15 м2 / г), за да се намали образуването на странични продукти на окисляване дълбоко [30,31]. Той установява, че при температури над 350 0 ° С, средата потоци на реакцията на мед окисляване на хлороводород с хлор и последната част на допълнителни трансформации. оксихлориране на скорост 1,2-дихлороетан е описан от уравнение (приет подобно за окислително хлориране на алкени [32]):
:
По този начин се постига балансирано процес на въглеводород.
метод за хидрогениране може да се използва при обработката на тетрахлорметан, освобождаването на което е забранено от Монреал протокол от 1987 година. в хлороформ: ССЦ 4 + Н2 ® CHCI 3 + HCl
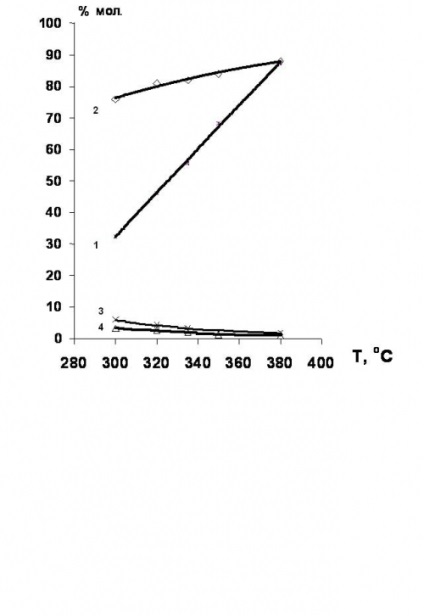
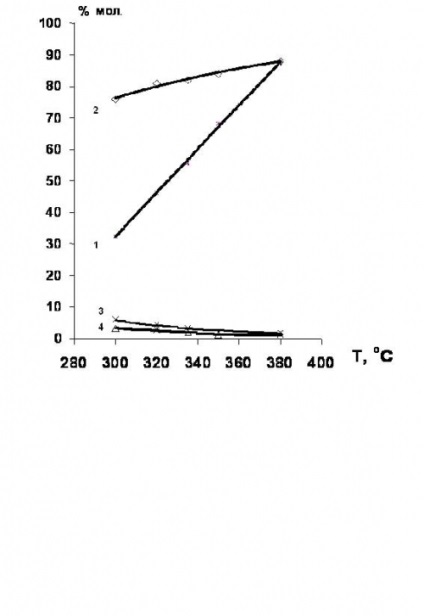
Основан [34,35], който hydrodechlorination на хлорирани етан-етилен серия се провежда за предпочитане в присъствието на никел-съдържащ катализатор. добива на етилен в този случай достигне 80% (Фигура 4).
Паладиеви катализатори са по-активни, но по-малко селективни от никел: основен продукт в този случай е етан, на изхода на който достига 70% и добивът на етилен не превишава 10-15%.
Както е показано [34], е за предпочитане най-hydrodechlorination механизъм предположи мултиплет разделяне на хлорни атоми от молекула на изходното съединение. скорост Hydrodechlorination реакция се изразява чрез следното уравнение:
Реактивност chloroolefins където по-ниски в сравнение с chloroalkanes [35].
Промишлено, процесът трябва да се извършва в катализатор с неподвижен слой, като се използва тръбен реактор. Температурата на 320-370 0 ° С, времето за контакт е 5-10 секунди, моларното съотношение на водороден атом на хлор е 0.5: 1.
Катализаторът разработен за този процес има висока стабилност.
За обработката на вторични отпадъци като хексахлорбензен, хексахлоретан, и др. Целесъобразно да се използват паладиеви катализатори. Obeskhlorennye органични продукти се изпращат допълнително за запалване и хлороводород могат да бъдат използвани в процеса.
Заключение.
процеси на синтеза на Индустриални стойност органохлорни ще се увеличат в бъдеще. Това се дължи на нарастващата потребност, интегрираната използването на минерални и органични материали, които в този случай включва сол продукти и рециклиране на нефт и природен газ. Необходимо условие за това е минимално въздействие върху околната среда. Прилагането на този принцип трябва да се прилага най-малко в две направления:
1. Установяване на процеси, напълно балансиран хлор и въглеводородна суровина;
2. Наличие на квалифицирана, екологично чиста технология за преработка на производството и потреблението на органохлорни продукти отпадъци.
Фиг.1. Lg зависимост от постоянна стойност на скоростта на реакцията # 61508 Н М-CI връзка.
_____ експериментални данни
------- оценка
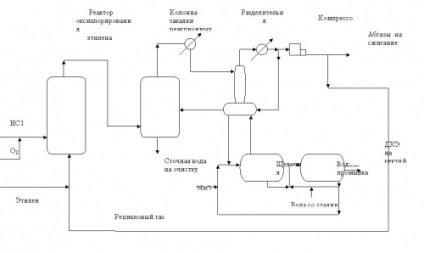
Фиг.2. Схема на процеса на оксихлориране на етилен в кипящ слой на катализатора
Фигура 3. Схема на процеса на оксихлориране на етилен в катализатор с неподвижен слой.
Фигура 4. Температура зависимост от превръщане на 1,2-дихлороетан и селективността на продуктите на хидрохлориране в присъствие на Ni-съдържащи катализатори.
1 - превръщане на 1,2-дихлороетан;
селективности: 2 - етилен; 3 - етан; 4-етил хлорид