1. Определение. Класификация.
2. изомерия и номенклатура на монокарбоксилни киселини
3. Физически свойства киселини
4. химически свойства. Структура на карбонилната група.
Карбоксилна киселина - въглеводородна производни, съдържащи карбоксилна група (-СООН).
Класификация на карбоксилни киселини
Карбоксилни киселини са класифицирани според две структурни характеристики.
1) Според броя на карбоксилни групи са разпределени в:
Ø едновалентен (монокарбоксилна)
Ø полиосновна (дикарбоксилна, трикарбоксилна и т. Д)
2) естеството на въглеводород радикал разграничи киселина:
граница вода (например, CH3CH2CH2COOH)
Ø ненаситен (СН2 = CHCH2COOH)
Ø ароматен (RC6H4COOH)
Ограничаване едноосновен карбоксилна киселина
Общата формула на такива киселини - CnH2nO2 или СпН2п + 1COOH
Номенклатура и изомерия карбоксилна киселина
Киселини с по-малко от четири въглеродни атома имат изомери. Ако броят е равен на четири атома, киселината има два изомери, освен ако броят на атомите е пет - пет изомери.
За да назоват вида киселини, следната номенклатура:
Имената са конструирани карбоксилни киселини използват като базова името на оцетна киселина. Други се считат като киселинни производни с заместване на водородни атоми на метиловата група в по-сложни радикали. Други правила са изцяло съобразени с правилата на рационална номенклатура за въглеводороди (детайли, посочени в началото на лекционния курс).
При получаване на заглавното карбоксилна киселина, като основа за вземане на най-дългата верига включително карбоксилната група. Номерацията започва с въглеродния атом на карбоксилна група (броят показва позицията на функционалните групи, които не дават). Към името на въглеводород в броя на въглеродните атоми в основната верига добавен суфикс -ovaya киселина. Numbers и префикси показват позицията и броят на заместителите.
Номенклатура Номенклатура на карбоксилни киселини еднакви алдехиди. което значително улеснява неговото разбиране и учене.
Имената на някои представители на карбоксилни киселини
Получаване на карбоксилни киселини
Много методи за получаване на едноосновни киселини са разгледани в предходните глави:
1) окисление на алкохоли
2) озонолиза на алкени
3) окисление на карбонилни съединения (алдехиди и кетони)
4) хидролиза на гем trigalogenproizvodnyh въглеводороди (подобно хидролиза digalogenproizvodnyh за получаване на алдехиди метод 5):
5) хидролизиране киселинни производни (халогенирани производни, естери, нитрили)
6) карбонизирането на органометални съединения
Той е универсален метод за получаване на карбоксилни киселини, лабораторен метод.
Долна киселина с С1 -С 3 атома - безцветна течност с характерна остра миризма.
Киселина състав на С4-С9 - е маслообразна течност с неприятна миризма, слабо разтворим във вода.
Киселина състав от С10 и по-високи - твърди вещества не са разтворими във вода.
По този начин, с увеличаване на молекулно тегло киселини разтворимостта във вода намалява.
Висока температура на кипене киселина, причинени от образуването на междумолекулни водородни връзки е свързан с това и добра разтворимост във вода (образуване на водородни връзки с водните молекули).
Силата на водородни връзки допринася за образуването на димери, които са стабилни дори в газообразно състояние.
Химични свойства киселини
Структурата на карбоксилната група
Карбоксилна група комбинира две функционални групи - карбонил и хидроксил, взаимно си влияят взаимно:
Киселинните свойства на карбоксилни киселини са изразени достатъчно ярко. Това се дължи на взаимното влияние на атомите в карбоксилната група. Плътността на електрони, които се замества с по-електроотрицателна кислород хидрокси група, която отслабва връзката ОН и улеснява отделянето на водороден атом ,. E.oblegchaet дисоциация киселина (това е така, защото + М ефект преобладава ОН група преди -I ефект) , Мобилността на протони, намиращи се в # 945 позиция също се определя от структурата на СООН групи (подробни обяснения са посочени в лекцията "Алдехидите и кетони").
1) киселинни свойства
Дисоциация на киселини. Водният карбоксилна киселина дисоциира в йони и имат кисела реакция. Тя може да се открие чрез индикатора, който се счита за качествено определяне на киселини. Например, лакмус се оцветява в червено.
Във воден разтвор, дисоциацията протича с образуването на стабилизиран заряд делокализация мезомерен анион.
подравнени граница резонансната комуникация структура O C-
Meso - на подравняване феномен на електронната плътност между двата кислородни атома.
Карбоксилната киселина силна киселина от алкохоли.
Мравчена киселина - най-мощният, поради липсата на електронния ефект на алкилови групи. Заместителите положителен индуктивен ефект (електрон - СН3, С2Н5) ниска киселинност разкъсване водородни от кислорода в ОН-групата по-трудно.
Образуването на сол. Киселините могат да образуват соли с метали, техните окиси и хидроокиси.
а) чрез реакция с метали:
2RCOOH + Mg ® (RCOO) 2mg + Н2
б) реакция с метални хидроксиди:
2RCOOH + NaOH ® RCOONa + H2O
2) Реакциите на групата ОН
Получаване на естери (R'-COOR ") - .. Тази реакция е реакция на естерификация между киселини с алкохоли в присъствие на минерални киселини Реакцията е обратимо.
оцетна киселина, етилов алкохол, етилов етер на оцетна киселина
Киселини линейна структура, като R-СН2-СООН, а реагира от разклонена верига киселина: R2CH-СООН, R3C-СООН. катализатор в реакцията на естерификация, Н + йони играят:
Реакцията протича по следния механизъм: кислород на карбонилна група и протон улавя I. Това образува carbocation carbocation отдава алкохол молекула поради самотните двойки на кислородния атом да образуват комплекс II. II комплекс, способен да образува обратимо carbocation гниене и III. която се образува по време на дисоциация естер (катализатор - с протонна се освобождава).
Голям интерес в тази реакция е проблемът: киселина или хидроксилна в алкохол се разцепва efiroobrazovaniya реакция. Използвайки "следящият индикатор" (18O тежки изотопи) е показано, че водата, образувана от водород и хидрокси киселина алкохол.
(Ако се използва етикет в алкохол кислород след това се образува вода съдържа обикновен кислород)
Реакциите с пълна замяна на ОН група.
Получаване на производни на карбоксилни киселини.
1) киселинни халогениди могат да бъдат получени чрез действието на фосфорен пентахлорид (PCL5), тионил хлорид (SOCl2).
2) халоген халогенид има висока реактивност, обаче халогениди се използват като ацилиращи агенти. Така получен киселинни анхидриди.
Напр, оцетен анхидрид (R = СН3), използвани в органичния синтез като силен дехидратиращ агент.
3) образуване на амиди на амоняк се извършва.
киселина, амониева сол
4) амонолиза киселини в присъствието на алуминиев води до образуването на нитрили.
Реакциите, при които водородните атоми са разположени # 945 въглероден атом.
Водородни атоми са изправени в 945 # позиция да ограничават киселини имат повишена подвижност поради elektronoottyagivayuschego карбоксил действие (виж структура обект "алдехиди и кетони.").
Специфични свойства има мравчена киселина. тъй като тя съдържа алдехидна група. Поради тази киселина има свойствата на редуциращ агент, например, дава реакция на сребро огледало. Нитрил мравчена киселина - не повече от tsinovodorodnaya H-CºN или циановодородна киселина.
Използването на отделните представители. Влияние върху човешкото здраве
се използва мравчена киселина за получаване на лекарствени средства, препарати за растителна защита, консерванти, за боядисване на текстил, има бактерицидно действие. След контакт с кожата причинява изгаряния.
Оцетна киселина се използва в производството на соли и естери (ацетати), лекарства, багрила и инсектициди. Това е консервант. Той причинява изгаряния.
Пропионова киселина е от съществено значение за синтеза на хербициди полимери.
По-ниските членове на редица киселини предизвикат дразнене и дихателна недостатъчност. Монокарбоксилни киселини като окислени междинни продукти на метаболизма в тялото. Ароматни киселини (бензоени) екскретират непроменени.
Висш киселина причини увреждане на черния дроб и промените в състава на кръвта.
Мазнини - естери на глицерола и висши едновалентни карбоксилни киселини.
Общо наименование на такива съединения - триглицериди или триацилглицероли, където ацил - остатък карбоксилна киселина -С (О) R.
Съставът на природни триглицериди включват остатъци на наситени киселини (палмитинова C15H31COOH, стеаринова C17H35COOH) и ненаситен (олеинова C17H33COOH, линолова C17H29COOH).
Мазнини се съдържат във всички растения и животни. Животински мазнини (.. овче, свинско, говеждо месо и т.н.), обикновено са твърди вещества с ниска точка на топене (с изключение - рибено масло). Мазнини са съставени главно от триглицериди гранични киселини.
Животински мазнини - масла (слънчоглед, соя, памук и др.) - течност (изключение - кокосово масло). Съставът на триглицеридни масла включват остатъци на ненаситени киселини.
Течните мазнини се превръщат в твърда чрез реакция на хидрогениране (хидрогениране). Когато този водород се добавя през двойната връзка, съдържаща се в въглеводороден радикал молекули масла.
Така се получи евтин "масло" масло. Такова масло е евтино, но не много високо качество, тя се разпада бързо (гранясал).
Продуктът на хидрогениране на масла - твърда мазнина (изкуствен мазнини, хидрогенирани мазнини). Маргарин - годни мазнина се състои от смес от хидрогенирани масла (слънчоглед, царевица, памук, и т.н.), Животински мазнини, мляко и ароматизиращи агенти (сол, захар, витамини и др.).
Мазнини като естери, характеризиращи се с обратима реакция хидролиза, катализирана от минерални киселини. С участието на алкална хидролиза на мазнини става необратимо. Продуктите в този случай са сапуни - соли на висши карбоксилни киселини и алкални метали.
Натриева сол - твърд сапун, калиев - течност. Реакция на алкална хидролиза на мазнини, и в общи всички естери също се нарича осапунване.
Ненаситените мастни: акрил и метакрилова.
Най-важните представители на ненаситени киселини са:
акрилова (акрилова киселина), СН2 = СН-СООН
метакрилова (2-metilpropenovaya киселина)
Акрилова киселина научи синтетично. Това е течност с остър мирис. Лесно е да се полимеризира до образуване полиакрилова киселина.
Значително практическо значение са естери на акрилова киселина, или по-скоро си полимеризационни продукти:
етилов естер на акрилова киселина
Полиакрилатите са прозрачни и се използват за производството на различни пластмаси и органични стъкло. По-голяма твърдост в сравнение с полиакрилати притежават метакрилат - естери на метакрилова киселина.
Най-добър органичен стъкло е плексиглас - полиметакрилова киселина метилов естер. Плексиглас се използва в медицината за производството на протези.
метакрилова киселина метилов естер
Най-общо, ненаситени киселини характерни много реакции характеристика на алкени: присъединяване халогени, водород към двойната връзка, окисление с калиев перманганат, синтез диен.
Двуосновен карбоксилни киселини.
Най-простият двуосновен киселина - оксалова (първо е намерено киселец) и етандиова киселина. Следващата представител - ябълчна или пропандиова киселина. Двуосновен киселини с четири въглеродни атома или янтарна наречени бутандионова.
Най-важното реакцията на такива киселини - получаване на кондензационни полимери.
реакции на естерификация и получаване на амиди на дикарбоксилни киселини са в основата на промишленото производство на изключително важно от практическа гледна точка на кондензационни полимери.
Кондензацията на дикарбоксилна киселина и алкандиол води до образуването на полиестера. Полиестерите са широко използвани в производството на синтетични влакна.
Един от най-важните полиестер - полиестер - получени чрез поликондензация на терефталова киселина и етилен гликол.
Кондензацията на дикарбоксилна киселина с диамин води до образуването на полиамид. Полиамиди се използват за производство на синтетични материали (синтетичен вълна). Важен практически цели полиамид - найлон 6,6 - получени чрез поликондензация на адипинова киселина и хексаметилендиамин.
В разпънат вид изглежда по следния начин:
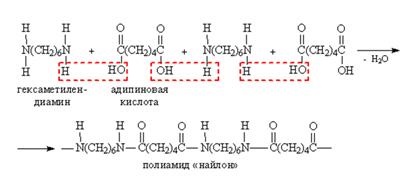
В "найлон-6,6" име на първия Числото показва броя на въглеродните атоми в дикарбоксилна киселина, а вторият - на броя на въглеродните атоми в диамин.
Ако сместа се подлага на процес на поликондензация на ароматна дикарбоксилна киселина (например, терефталова киселина) и ароматен диамин, получените полиамидни материали с подобни сила стоманени продукти:
