§ 120. Fe Желязо (преход група VIII група)
Инцидентно подгрупа от група VIII на периодичната таблица на Менделеев разлика от други триада се състои от три елемента: желязо Fe, Co кобалт, никел Ni семейство включва желязо, рутений Ru, Rh родий, паладий Pd, Os осмий, иридий и 1г платина Pt включва платина семейство метал, въз основа на сходството на техните свойства.
Помислете желязо като представител на семейството му от подгрупа VIII в странична група. Желязото е в четвъртия период.
Атомното тегло на желязо 55, 84, 26 зареждане на ядрото. Разпределението на енергия на нивата на енергия (26): 2, 8, 14, 2. Електронната конфигурация на външната и predvneshnego 3s23p63d64s2 желязо слой.
По този начин, железни атоми, в допълнение към два S-електрони четвърти външен слой има шест електрони г predvneshnego трети слой. От тези г електрони са най-активни 4 несдвоен. Следователно, образуването на валентните връзки на желязо особено активна част 6 електрони - от външен 2 и 4 на predvneshnego слоеве. Най-разпространени са степените на окисление на желязо Fe 2 и Fe 3. Желязо - един от най-често срещаните елементи в природата. Тъй като разпространението на това на четвърто място сред другите елементи.
■ 57. Въз основа на структурата на железния атом и разпределението на електроните орбитали, изберете възможните окислителни състояния на елемента. (Вж. Response)
Желязо в свободно състояние е сребристо-сив лъскав метал с плътност 7,87, точка на топене 1535 ° С и точката на кипене 2740 °. Желязо е постановил феромагнитни свойства, т.е.. Д. Под влияние на магнитното поле, когато намагнитва и прекратяване на полеви магазините самите магнитни свойства се превръща в магнит. Тези свойства са всички елементи на желязо група.
Чрез химични свойства на желязо е много активен метал. При липса на желязо влага във въздуха не се променя, но когато са изложени на влага и кислород, се подлага на силна корозия и ръжда обхванати от насипно филм, който е железен хидроксид, който не го предпази от по-нататъшно окисление, и желязо бавно се окислява в цялата си маса:
4Fe + 2H2O + 3O2 = 2Fe2O3 · 2H2O
Редица методи за защита на благородни метали от корозия.
Сред стрес желязо се оставя на водород. В тази връзка, тя лесно се подлага на действието на разредена киселина, превръщане на сол на двувалентен желязо, като например:
Fe + 2HCl = FeCl2 + Н2 ↑
С концентрирана сярна и азотна киселини, желязо не реагират. Тези киселини произвеждат върху металната повърхност плътна и здрава оксид филм, метал става напълно пасивно и не влиза в други реакции. В същото време, в тясно сътрудничество със силни окислители като халогени. Винаги желязо има степен на окисление 3:
2Fe + 3Sl2 = 2FeCl3
Желязо реагира с прегрята пара; с водород от вода се измества. гореща желязо се превръща в окис, и това е винаги или железен оксид FeO, или оксид-железен оксид Fe3O4 (Fe2O3 · FeO):
Fe + H2O = FeO + Н2 ↑
3Fe + 4H2O = Fe3O4 + 4H2 ↑
Разтопено желязо в чист кислород изгаряния енергично, за да се образува железен оксид (вж. Фиг. 40).
3Fe + 2O2 = Fe3O4
Калциниране желязо алуминиеви форми с въглеродния и желязо едновременно Fe3C карбид.
■ 58. Списък на физичните свойства на желязо.
59. Какви са химични свойства на желязото? Дайте мотивиран отговор. (Вж. Response)
§ 121. Съединения желязо
Желязо образува две серии от съединения - съединенията Fe 2 и Fe 3. Характеризира се с две железен оксид - азотен оксид, FeO и Fe2O3. Въпреки това, известно смесен оксид, Fe3O4, чиято молекула е съединение с кислород и фери желязо: Fe2O3 · FeO. Това оксид е известен също като железен оксид или смесени оксиди на желязо.
Съединения цветни по-малко стабилен от оксид и в присъствие на окислител, дори ако тя е само въздух кислород, обикновено се трансформира в съединение с тривалентно желязо. Например, железен хидроксид (II) Fe (ОН) 2 е бяло твърдо вещество, в чист вид, но може да се получи само когато разтворите на реагентите не съдържат разтворен кислород и реакцията се провежда в отсъствие на въздух кислород:
FeSO4 + 2NaOH = Fe (ОН) 2 + Na2SO4
Сол, от която хидроксид на желязо (II), разбира се, не трябва да съдържа най-малките примеси оксид съединения. Тъй като са създадени тези условия по конвенционален лаборатория обучение много трудно, железен хидроксид (II) се получава под формата на повече или по-малко тъмно зелено желеобразна форма утайка, което показва, че окислението срещащи се съединения железен да железен. Ако железен хидроксид (II) притежават за дълго време във въздуха, тя постепенно е превръщането му в железен хидроксид (III), Fe (ОН) 3:
4Fe (ОН) 2 + 2H2O + O2 = 4Fe (ОН) 3
Желязо хидроксид са типични неразтворими хидроксиди. железен хидроксид (II) имат основни свойства и у хидроксид Fe (ОН) 3 много слабо изразени амфотерни свойства.
■ 60. Списък свойства на железен оксид като типичен основния оксид. Дайте мотивиран отговор. Всички реакции пишат имената и акроними йонни форми. (Вж. Response)
61. Списък свойства на железен хидроксид (II). Потвърдете вашия отговор на реакцията уравнения. (Вж. Response)
Сред железни соли (II) има най-голяма стойност железен сулфат FeSO4 · 7H2O, който включва 7 молекули кристализационна вода. Железен сулфат е силно разтворим във вода. Той се прилага за борба с вредители на селското стопанство, както и в производството на бои.
най-важното е железен хлорид FeCl3, която е силно хигроскопични оранжеви кристали, които абсорбират вода, когато се съхранява в кафяво и размазване паста на железни соли.
соли на желязо (II) може лесно да се движат в желязната сол (III), например чрез загряване с азотна киселина или калиев перманганат в присъствието на сярна киселина:
6FeSO4 + 2HNO3 + 3H2SO4 = 3Fe2 (SO4) 3 + 2NO + 4N2O
Соли на Fe 2 Fe 3 окисление в солта може да се появят под влиянието на въздуха кислород по време на съхранението на тези съединения, но този процес е по-дълго. За разпознаване на Fe2 + и Fe3 + катиони са много характерни за специфични реагенти. Така например, за откриване на железен вземат червено Blutwurst сол K3 [Fe (CN) 6], което в присъствието на феройони, даващи им характеристика синьо утайка turnbulevoy интензивно синьо:
3FeSO4 + 2K3 [Fe (CN) 6] = Fe3 [Fe (CN) 6] 2 + 3K2SO4
или в йонна форма
3Fe 2+ + 2 [Fe (CN) 6] 3- = Fe3 [Fe (CN) 6] 2
За разпознаване на Fe3 + соли използва реакция с фероцианид сол К4 [Fe (CN) 6]:
4FeCl3 + 3K4 [Fe (CN) 6] = Fe4 [Fe (CN) 6] 3 + 12KCl
4Fe 3+ + 3 [Fe (CN) 6] 4- = Fe4 [Fe (CN) 6] 3
В този случай попада интензивна синя утайка от пруски синьо. Turnbuleva пруски синьо и синьо се използват като оцветители.
В допълнение, тривалентно желязо може да бъде разпозната с помощта на разтворими соли - калиев тиоцианат KCNS или амониев тиоцианат NH4CNS. В реакцията на тези материали с Fe соли разтвор (III) беше кръв червено.
■ 62. Списък свойства и соли Fe 3 и Fe 2. Какво е състоянието на оксидация е по-стабилен?
63. Как да се извърши преобразуването на солта Fe 2 Fe 3 в сол, както и обратното? Дайте примери. (Вж. Response)
Реакцията протича съгласно уравнението:
FeCl3 + 3KCNS = Fe (CNS) 3 + 3KSl
или в йонна форма
Fe3 + + 3CNS - = Fe (CNS),
железни съединения играят важна роля в живота на организмите. Например, това е част от главната кръв протеин - хемоглобин, както и зелено вещество на растенията - хлорофил. Желязо влиза в тялото, съставен главно от органични вещества хранителен продукт. Много желязо, съдържащ ябълки, яйца, спанак, цвекло. Тъй като лекарства, използвани под формата на железни соли на органични киселини. Железен хлорид е хемостатичен агент.
■ 64. Трите тръби включват: а) желязо сулфат (II), б) железен сулфат (III) и в) железен хлорид (III). Как да се определи коя тръба, която сол?
65. Как да се прилагат редица трансформации:
Fe → FeCl2 → FeSO4 → Fe2 (SO4) 3 → Fe (ОН) 3 → Fe2O3.
66. Като се имат предвид следните вещества. желязо и солна киселина. хлор. сода каустик. Както се използват само тези вещества, за да се получи железен хидроксид (II) хидроксид и желязо (III)?
67. Разтвор на хромен хлорид (III) хлорид и желязо (III), обработва се с излишък от алкален. Получената утайка се отфилтрува. Това, което остава върху филтъра и във филтрата които са преминали? Даде мотивиран отговор чрез използване на уравненията на реакции в молекулните, йонни пълни и намалени йонни форми. (Вж. Response)
§ 122. сплави на желязото
Желязото е основата за стоманодобивната промишленост, така че се произвежда в големи количества. Новата програма на цялостен сградата на комунизма е свързан с производството на 250 млн. Тона стомана през 1980. Това е 3,8 пъти повече, отколкото през 1960 г.
Желязото е почти никога не се използва в чист вид, но само под формата на сплави. Най-важните сплави от желязо са сплави с въглеродни емисии - различни чугуни и стомана. Основната разлика от съдържанието на желязо стомана въглерод: в желязото съдържа повече от 1,7% въглерод, и стомана - по-малко от 1,7%.
Голямо практическо значение са феросплави (сплав от желязо и силиций), Ферохром (сплав от желязо и хром), Ferromanganese (сплав от желязо и манган). Феро - е чугуни, съдържащи повече от 10% желязо и поне 10% от съответния компонент. В допълнение, те съдържат същите елементи като в желязото. Феросплави се използват главно, когато "дезоксидация" както стомана и добавки.
Сред отличава желязо и стомана вземане на линия. Чугунена използва за отливане на различни части, свине-разтопи стомана, тъй като има много висока твърдост и не може да бъде обработен. Чугун е бял и леярната - сив. Чугун съдържа повече манган.
Стомана са въглерод и сплав. Въглеродна стомана обикновено са сплав на желязо с въглерод и легиран с добавки включват, т. Е. други метали примеси, предаващ станат по-ценни свойства. Ванадий дава стомана еластичността, еластичността, стабилността по време на охлаждане, волфрам и молибден - твърдост и устойчивост на топлина. Стомани с циркониеви добавки на много еластична и пластмаса; тяхното използване за производството на броня плочи. Примесите правят манганова стомана устойчива на удар и триене. Борен подобрява режещите свойства на стоманата при производството на инструментални стомани.
Понякога дори малки примеси редки метали придават нови свойства на стоманата. Ако се поддържа стомана част берилий прах при температура 900-1000 °, твърдостта на стоманата, неговата устойчивост на износване значително увеличен.
Никел-хром, или, както ги наричат, неръждаема, стомана, устойчиви на корозия. Силни стоманени вредни примеси на сяра и фосфор - те правят метал крехки.
■ 68. Кои са най-важните железни сплави, които са известни с теб? (Вж. Response)
69. Каква е основната разлика между стомана от желязо?
70. Какви са качествата на чугун и чугун кои видове знаеш?
71. Това, което е легирани стомани и сплави добавки? (Вж. Response)
§ 123. Процесът на пещ взрив
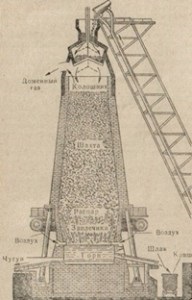
Фиг. устройството 83. верига на доменна пещ.
Той пропуска дълъг вал пещта, надолу различаващи, улесняване на движението на фуражната суровина, от горе на долу. Тъй като движението на таксата до най-широката част на пещта - пара - тя се подлага на серия от трансформации, в резултат на което един глас, вливащи се в пещта - най-горещата част на пещта. Там също ще шлака. Желязо и шлака изпуска от пещта през отворите в пещта, наречен стъпалните отвори. Чрез горната част на огнището на доменната пещ се вдухва въздух, който поддържа горенето на гориво в пещта.
Разглеждане на химични процеси в топене на желязо. Зареждането на сложни вещества доменната пещ, т. Е. заредени в него, се състои от желязна руда, гориво, и потоци или втечняващи агенти. Желязната руда, те са много. Основната руда - магнетит Fe3O4, Fe2O3 хематит, лимонит 2Fe2O8 · 3H2O. В процеса на високите пещи в желязната руда се използва като сидерит FeCO3, а понякога и пирит FeS2, превръщайки след пещи за изпичане на пирит сгурия в Fe2O3, който може да се използва в металургията. Тази руда е по-малко желателно поради високите серни примеси. Претопи в доменна пещ не само желязо, но също така и феросплави. Гориво зарежда в пещта, едновременно служи за поддържане на висока температура в пещ за намаляване на желязо от руда, и участва в образуването на въглероден сплав. Горивото е обикновено кокс.
В процеса на топене на желязо кокс газифицира, струговане, като газов генератор, първоначално диоксид и след това въглероден монооксид:
C + O2 = CO2 + CO3 С = 2CO
Въглеродният оксид е добър намаляване на газ. С помощта на намаляване на желязна руда се случва:
Fe2O3 + 3SO = 3SO2 + 2Fe
Заедно с руда, съдържаща желязо в пещта се изисква да падне скални примеси. Те са високо огнеупорни и могат да блокират пещта, което работи непрекъснато в продължение на много години. За скални примеси се отделя лесно от пещта, той се превръща в лесно топими съединение, превръщане потоци (флюс) в шлаката. За прехвърляне в шлаката основни скали, съдържащи, например, варовик, които се разлагат в пещта съгласно уравнението
СаСО3 = СаО + CO2
добавя пясък. Той е легирана с калциев оксид, силикатни пясъчни форми:
СаО + SiO3 = CaSiO3
Това вещество е много по-ниска точка на топене. В течна форма, той може да бъде освободен от пещта.
Ако киселите видове, съдържащи голямо количество силициев двуокис, след това се поставят в пещта, напротив, варовик, което се превежда силикат силициев диоксид, и резултатът е същата шлака. Преди шлака е отпадък, а сега се охлажда с вода и се използва като строителен материал.
За да се поддържа горенето на гориво в доменната пещ се подава непрекъснато предварително загрята, обогатен с кислород въздух. Тя се нагрява в специални печки - kiuperah. Cowper - висока кула, изградена от огнеупорни тухли, където димните газове от доменната пещ горещо. Домейни газове СО2 съдържат въглероден диоксид, азот N2 и въглероден оксид CO. Въглеродният окис се изгаря в Cowper, което води до повишаване на температурата. Тогава доменни газове автоматично се насочват към друг Cowper, и през първата чистка въздуха започва насочени в доменната пещ. В горещия въздух затопля Cowper, като по този начин спестяване на гориво, който в големи количества ще се консумира за отопление влизане доменната пещ въздуха. Всеки от доменни пещи, има няколко cowpers.
■ 72. Какъв е съставът на таксата, доменната пещ? (Вж. Response)
73. Списък основни химични процеси при топене на желязо.
74. Какъв е съставът на доменен газ и как тя се използва в Cowper?
75. Колко желязо, съдържащ 4% въглерод може да се приготви от 519, 1 кг магнетит, съдържащи 10% примеси?
76. Как много коксови добиви на въглероден окис достатъчно, за да се възстановят 320 кг железен оксид когато кокс съдържа 97% чист въглерод?
77. Как трябва да се лекува сидерит и пирит. че човек може да получите желязо? (Вж. Response)
§ 124. при производството на стомана
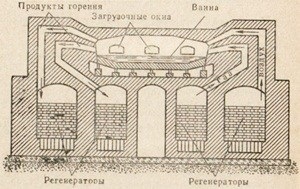
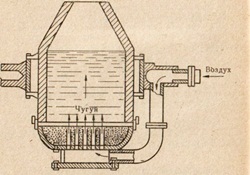
Фиг. 85. схема устройство Bessemer конвертор
В електрическата пещ (фиг. 86) се стопява, легирана стомана специални класове главно с висока точка на топене и съдържащ кобалт. хром. волфрам, и други добавки. Готовият стомана отнася до търкаляне. Има срещу огромна валцуване - цъфнали мелници и slabbing - гофрирани горещи блокове стомана с помощта на ролки, което позволява производство на стоманена лента в различни форми.
Желязо под формата на сплави се използват широко в националната икономика. Без него не прави всеки един сектор на икономиката. За да се спаси цветни метали присъстват, колкото е възможно, за да се опитат да ги замени с синтетични материали.
От желязо или стомана произвежда машини и автомобили, самолети и инструменти, клапани за бетонни конструкции, консервни кутии калай и покрив ламарина, кораби и мостове, селскостопанска техника и греди. тръба и различни стоки за домакинството.
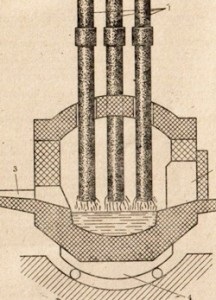
Фигура 86. Схема на пещ дъга.
1 електрод и зареждане отваряне 2-, 3- корито за производство на стомана, ротационен механизъм 4-
знам как
