Модерна промишлена технология за производство на етанол от сурови храни се състои от следните стъпки:
§ Подготовка и усъвършенстване на скорбяла суровини - зърно (най-вече - ръж, пшеница), картофи, царевица и др ...
§ ферментация. На този етап ензимно разграждане на нишесте до ферментиращи захари. За тази цел се използват рекомбинантни препарати на алфа-амилаза, произведен от биотехнологично инженерство - glyukamilaza, Amilosubtilin.
§ ферментация. Благодарение на дрожди ферментация на захари в алкохол е натрупване на Braga.
§ bragorektifikatcii. Тя извършва върху колоните на ускорението.
ферментация производствени отпадъци са въглероден диоксид, Bard, етер-алдехид фракция, фузелово алкохол и фузелово масло.
Изпълнението на модерна дестилерия на около 30 000-100 000 литра алкохол на ден.
В индустриален мащаб етанол получава от суровини, съдържащи целулоза (дърво, слама), които са хидролизирани. Получената смес на пентози и хексози се подлага на алкохолна ферментация. В Западна Европа и Америка, тази технология не е широко разпространена, но в Съветския съюз (сега в България) има развита индустрия на фуражна мая и хидролиза на хидролиза на етанол.
В промишлеността, в допълнение към първия метод, като се използва етилен хидратация. Хидратацията може да се извършва чрез две схеми:
§ директно хидратация при температура от 300 ° С, налягане от 7 МРа, като се използва катализатор, ортофосфорна киселина, отложен върху силика гел, с активен въглен или азбест:
§ стъпка хидратация чрез естер междинно съединение сярна киселина, последвано от неговата хидролиза (при температура от 80-90 ° С и налягане от 3.5 МРа):
Тази реакция се усложнява от образуването на диетилов етер.
Етанол, произведен от хидратация на етилен, или ферментация, е вода-алкохолна смес, съдържаща примеси. От своя индустриален, храна и прилагане фармакопея трябва да се почисти. Фракционна дестилация осигурява етанол концентрация от около 95.6% (тегл.); Това азеотропна дестилация неразделима смес съдържа 4.4% вода (тегл.) И има точка на кипене от 78,15 ° С
Дестилация на етанол от двете версии на летливи и тежки фракции от органични вещества (дъно).
Абсолютен алкохол - етанол същество свободен от вода. Това кипи при температура от 78,39 ° С, докато отстранени алкохол, съдържащ не по-малко от 4.43% вода кипи pri78,15 ° С Получават се чрез дестилиране на воден алкохол, съдържащ бензол и други методи.
Външен вид: при нормални условия е безцветна летлива течност с характерна миризма и вкус изгаряне. Етилов алкохол е по-лек от водата. Е един добър разтворител други органични veschestv.Sleduet избегне популярни грешки: често смесена собственост 95,57% алкохол и абсолютна. Техните свойства са почти едни и същи, но стойностите започват да се различават, като се започне 3-4-ия знак след десетичната запетая.
Реагира с алкални метали, за да се образува етилати (или в общия случай - алкохолати) и водород.
Реакции с карбоксилни киселини за образуване на естери:
Регистриран на дехидратиране в присъствието на сярна киселина (при 120 ° С), за да се образува етер:
Burns на въздух и кислород за производство на топлина:
Хидриди и взаимодейства с хидроксиди на алкални метали, за да образуват етилати:
Gidrogalogenirovaniya влиза в реакция в присъствието на цинков хлорид:
Етанолът може да бъде използван като гориво в т ч за ракетни двигатели (например етанол се използва като гориво в първия в света сериен балистични ракети - немски "-2 V") .., Двигател с вътрешно горене в чист вид. Ограничено поради тяхната хигроскопичност (беля) се използва в смес с конвенционални течни петролни горива. Използвани за генериране на висококачествени компоненти гориво и бензин - Етил трет-бутил етер, неизкопаем органичен от МТВЕ.
§ е суровина за много химически съединения, като ацеталдехид, диетилетер, тетраетил, оцетна киселина, хлороформ, етил ацетат, етилен и др.;
§ е широко използван като разтворител (в производството на бои, в производството на домакински химикали, както и много други области);
§ е компонент на антифриз и измиване;
§ в домакинството етанол се използва в почистващи препарати и перилни препарати, особено за грижите на стъклото и тела. Е разтворител за репеленти.
§ на действие етилов алкохол може да се дължи антисептици;
§ както дезинфекция и podsushivayuschee означава външно;
§ podsushivayuschee и дъбилни свойства 96% етилов алкохол, използван за полето за обработка операция, или в ръцете някои техники за обработка хирург;
§ разтворител за лекарства за получаване на инфузии, екстракти от растения и др.;
§ консервиращи тинктури и екстракти (минималната концентрация от 18%);
§ антиразпенващ агент заедно с кислород, механична вентилация;
§ в горещ компрес;
§ физически охлаждане с температура (за триене) [3];
§ компонент на обща анестезия в ситуация на дефицит наркотици;
§ като отнемане на пяната средство в белодробен оток под формата на инхалационен разтвор на 33%;
§ етанол е антидот за отравяне от някои токсични алкохоли като метанол и етилен гликол. Неговото действие се дължи на факта, че fermentalkogoldegidrogenaza, когато има множество субстрати (например, метанол и етанол) носи конкурентно окисление, при което след своевременно (почти незабавно, последвано от метанол / етилен гликол) етанол часова намалява ток концентрацията на токсични метаболити (метанол - формалдехид и мравчена киселина, етилен гликол - оксалова киселина) [4].
Парфюми и козметика
Е универсален разтворител на различни вещества и основният компонент на парфюми, одеколон, аерозоли и т. П. част на различни средства, включително и като пасти за зъби, шампоани, душ и други подобни. D.
Разтворителят за хранителни аромати. Тя може да се използва като консервант за печени изделия, а също и в производството на сладкарски изделия. [6]
Регистрирани като хранителна добавка E1510 [7].
Енергийна стойност на етанол - 7,1 ккал / г.
Формалдехид (от Латинска форма # 299; ва «мравка".) - безцветен газ с остър мирис, разтворим във вода, алкохоли и полярни разтворители. Дразнещ, токсичен.
Формалдехид - първи член на хомоложна серия от алифатни алдехиди, алдехид мравчена киселина.
Поради ниската плътност на електрон формалдехид въглеродния атом лесно реагира дори със слаби нуклеофили. Това по-специално поради факта, че във водни разтвори на формалдехид е в хидратирана форма.
Формалдехид влиза във всички реакции, характерни за алифатни алдехиди. По-специално, реакции с нуклеофили и редуциращи агенти.
Основният промишлен метод за производство на формалдехид - окисление на метанол:
Окисляване на метанол до формалдехид се извършва с помощта на сребърен катализатор при температура от 650 ° С и атмосферно налягане. Този процес е добре усвоили и 80% формалдехид се получава по този метод. Напоследък се развиват по-обещаващ метод се основава на използването на желязо-молибденови катализатори. Когато тази реакция се провежда при 300 ° С В двата процеса, превръщането е 99% [1].
Процесът на дехидрогениране метанол прилагат на цинк-мед катализатори при 600 ° С, още не е получил широко развитие, обаче, е много обещаващо, тъй като той позволява да се получи формалдехид не съдържа вода.
Има и промишлен метод за производство на формалдехид чрез окисление на метан:
Процесът се провежда при температура от 450 ° С и налягане 1-2 МРа, катализаторът се използва алуминиев фосфат AlPO4.
Безопасност и токсични свойства
Формалдехидът се произвежда в тялото чрез окисление на метанол.
Токсичен, то влияе неблагоприятно на генетичен материал, репродуктивни органи, дихателните пътища, очите, кожата. Той има силен ефект върху централната нервна система.
Максимално допустимата концентрация (МРС) формалдехид: [2] [3] [4]
§ MPCwa = 0,5 мг / m³
§ PDKm.r. = 0.035 мг / m³
§ PDKs.s. = 0.003 мг / m³
Летална доза 35% воден разтвор на формалдехид (формалин) е 10-50 грама
Водният разтвор на формалдехид - формалин - причинява денатуриране на протеините, така че се използва като тен агент в обработка кожа и тен желатин в proizvodstvekinofotoplonki. Поради силното действие на формалдехид тен е силен антисептик, е собственост на формалин се използва в медицината като антисептик (Formidron, Formagel и подобни лекарства), и за запазване на биологични материали (създаването на анатомични и други лекарства).
По-голямата част от формалдехид отива за производство на полимери, термореактивни (фенол-формалдехид и меламин формалдехидни смоли karbamidformaldenidnye), също така е широко използван в промишлен органичния синтез (пентаеритритол, триметилолпропан и т.н.).
Формалдехидът добра разтворимост. във вода, алкохоли и др. Polar р-celeration. При ниски т-ма смесим във всякакви пропорции с неполярен р-erator: толуен, диетил етер, етил ацетат, CHCI 3 (с увеличаване на трет-Ry р-rimost капки) не зол. в петролев етер. Вода-р RY съдържа формалдехид равновесна смес монохидрат СН2 (ОН) 2 (99.9%), нестабилна в Своб. състояние и polimergidratov НО (СН2) пН (п = 2-8) устойчиво кристално. съединения. Кога ще продължи. съхраняване воден р-ров (особено при ниска Т-ма) и тяхната степен концентрация polimerizatsiiuvelichivaetsya. За съхранение на воден формалдехид р-ров се стабилизира с метанол (вж. Формалин). След изпаряване на воден р-рова във вакуум obrazuetsyaparaform или paraformalde употреба (СН2 О) N (п = 8-12), под действието на алкален на конц. вода-R-RY -. т.нар. а-полиоксиметилен (п> 100). Полимеризацията в неполярен р-erator води до полиацетал (п> 1000).
Параформалдехидът - bestsv. кристали с миризма на формалдехид, т. пл. 120-170 0 ° С, в студена вода област ryaetsya бавно в гореща -Quickly образуващи р-RY формалдехид лоша разтворимост. ацетон; запалим, т.е.. ОСП. 72 0 С
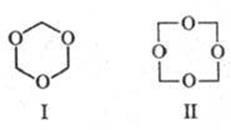
Известен цикличен. формалдехидни полимери: триоксан (.. е ла I, т.т. 64 0 ° С), получена от дестилацията на 60% воден разтвор на р-ра формалдехид с разредена. H2 SO4. и tetraoksimetilen (Формула II, т. на топене. 112 0 ° С), образуван по време на нагряването. диацетат Vysokomol. POM.
Формалдехидът е висока реактивност. Н2 в присъствието възстановено. Много метали или метални оксиди (например Ni, Pt, Cu.) В метанол; окислява HNO3. KMnO4 към мравчена-ви или СО2 и Н2 О; утаява повече. метали (Ag, Pt, Au, Bi, и т.н.) на р-Ing техните соли, характеризиращ се окислява до мравчена-ТУ.
С алдехид в присъствието. силни основи формалдехид влиза в т. наречен. р-ТА напречно Cannizzaro (С6 Н5 СНО + НСНО С6 Н5 CH2 OH + HCOONa); с ацеталдехид в присъствие. Са (ОН) 2 форми пентаеритритол, в парна фаза при 285 0 ° С - акролеин; под действието на Mg или Al алкоксиди формалдехид претърпява диспропорциониране да образуват Me-tilfomiata (вж. Тишенко реакция).
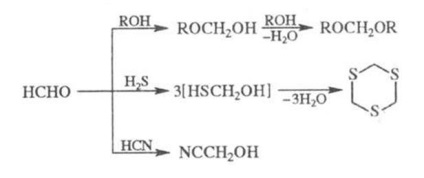
P-TION на формалдехид с алкохоли в присъствие. т-силна, за да доведе до ацетал (формално), с Н2 S - до циклична. тритианил с HCN при наличие. основи - ktsiangidrinu:
Формалдехидът е прикрепен към олефини в присъствие. киселинни катализатори, за да образуват 1,3-дигликол и 1,3-диоксани (вж. Prins реакция), р-ТА на формалдехид с изобутилен изопрен дава с фаза пропилей кондензационната течност в присъствие. BF3 или H2 SO4 - бутадиен. От формалдехид и кетек в абитуриентски-STI получи б-пропиолактон.
P-TION на формалдехид с ацетилен - Ind. Метод за получаване на бутадиен (вж. Reppe реакция), във взаимодействието. две молекули на формалдехид с atsetilenomobrazuetsya 2-бутин-1,4-диол.
Предварително зададените. вар формалдехид се превръща в въглехидрати:
При взаимодействието. формалдехид с хексаметилентетрамин образува NH3, с първични амини - тримери, с вторични - бис (ди-алкиламино) метани:
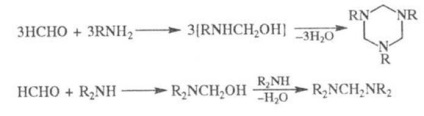
Кон. лабилна водород, се привежда във взаимодействие с формалдехид и NH3 (или амини) чрез реакция на Mannich. P-TION на формалдехид с NH4 Cl Ind. Метод за получаване на метиламин: 2NSNO + NH4 Cl СН3 NH2-HCl + НСООН (р-ТА може да продължава да се образува ди- и триметиламин). С урея формалдехид при алкални условия дава dimetilolnye моно- и техни производни за поликондензация ryh подготвени карбамид-формалдехидни смоли, и izmelamina formaldegida- и меламин-формалдехидни смоли.
Пропилей (пропен) СН2 = СН-СН3 - ненаситен (ненаситен) въглеводород серия етилен горивен газ. Drug с наркотичен ефект по-силна от тази на етилен. Клас на опасност - на четвърто. [1].
Пропилей е газообразно вещество с ниска точка на кипене т.к. = -47,7 ° С и точка на топене Т.т. = -187,6 ° С оптичната плътност на 4 d20 = 0,5193.
Той има значителен реактивност. Неговите химични свойства се определят от въглерод-въглерод двойна връзка. р-връзка като малко издръжлив и по-достъпни, докато действието на реактив е счупен и освободените валентността въглеродни атоми са изразходвани за свързване на атомите, които образуват молекулата на реагент. Всички реакцията на свързване се пристъпи към двойната връзка и се състои в разделяне π-алкен комуникация и образование на приземния счупване на две нови # 963; -връзките.
Най-често срещаните реакции се присъединяват за хетеролитично тип, като електрофилно присъединяване.
халоген присъединяване (халогениране)
Реакцията на халогениране се провежда обикновено в разтворител при обикновена температура. Халогени лесно да се присъединят в място скъсване на двойната връзка, за да се образува digalogenoproizvodnyh. Това е по-лесно прикрепване на хлор и бром, по-трудно - йод. Флуор реагира експлозивно.
] Водород присъединяване (хидрогениране реакция)
Чрез добавяне на водород в присъствието на катализатори (Pt, Pd, Ni), пропен става наситена въглеводородна - пропан.
връзка вода (хидратация реакция)
Пропилей реагира с вода за образуване на моноалкохол изопропанол, където е разкрито двойната връзка.
халогениди присъединяване (Hhal)
Среща Markovnikov правило. Водородът Hhal киселина е свързана към най-хидрогенира въглероден атом на двойната връзка. Съответно Hal остатък се свързва с въглеродния атом, при който минимален брой водородни атоми.

Пример gidrogalogenirovaniya - получаване бромо производно чрез взаимодействие на НВг пропан и пропилей.
Вижте също :. Gidrogalogenirovanie алкени
на въздуха за горенето
Burns при запалване на въздуха: 2СН2 = СНСН3 + 9O2 → 6N2 + 6SO2 О.
Тъй като кислород във въздуха, форми на пропилей газ експлозивни смеси.
В неутрална или слабо алкална водна среда пропилей се окислява с калиев перманганат, което е съпроводено с промяна на цвета и образуване на KMnO4 гликоли разтвор (съединения с две хидроксилни групи при съседни въглеродни атоми). Тази реакция се нарича реакция на Вагнер.
Условия на реакцията: топлина, присъствието на катализатори. Молекулата на съединение става чрез разцепване на вътрешномолекулни я-връзки, образуване на междумолекулна нов и # 963; -cvyazey.
Свързани статии
