Важна стъпка във всеки имунохистохимичен метод е визуализацията на резултатите от реакцията на "антиген-антитяло". За идентифициране на антитела, свързани към антиген с помощта на различни маркери може да бъде свързана с Fc-фрагмент антитела. Тези етикети могат да бъдат:
Въпреки това, флуоресцентни маркери имат своите недостатъци:
Ето защо, в бъдеще са разработени методи за получаване на стабилни цветове, които лекарства могат да бъдат разследвани от конвенционалната светлинна микроскопия и се съхраняват в продължение на дълги периоди от време.
Най-простият маркер, за да се получи лекарства с дълъг срок на годност са метали като колоидно злато. В реакция "антиген-антитяло" на мястото на концентрации на антитяло в светлинен микроскоп показа оцветяване в тъмен цвят. За дълго време, метални белязани антитела рядко използвани поради ниска чувствителност, но в 1989 godu чувствителност се повишава от 100 пъти по метода на амплификация със сребро и поляризирана светлинна микроскопия [7]. В редки случаи, при използване на антитела, белязани с тежки метали за последващо електрон микроскопски изследвани лекарства.
Радиоизотопи също се използват много рядко, поради високия риск от излагане на персонала. Радиоактивно белязаните антитела в момента се използват само за изследвания върху живи клетъчни култури. След обработка, тъканна култура антитяло радиомаркираните от степента на излъчване може да се съди за броя на желания антиген в тъканите.
Най-широко използваните ензимни етикети [4]. Една молекула на ензим конюгат с антитяло може да "лечение" голям брой субстратни молекули, полученият неразтворим багрилото се натрупва в тъканите около фиксираната антитяло към антигена.
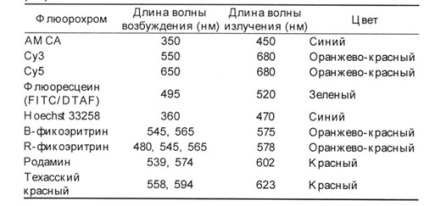
Таблица 1. Характеристики на най-често използваните Флуорохромните.
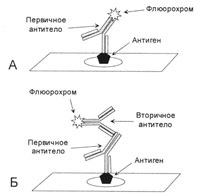
Фигура 1. Преки и непреки метод рендиране
А - първично антитяло срещу антигена съдържа етикет като флуорохром. Б - първично антитяло срещу антигена не етикет, след инкубиране с първичното антитяло се добавя вторично антитяло, което се свързва с основната. Етикетът се намира на второ антитяло.
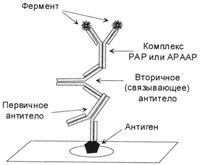
Фигура 2. Полученият комплекс, образуван по време на метода на PAP.
Първичното антитяло и анти-PAP пероксидаза в комплекса да бъдат получени от животни от същия вид.
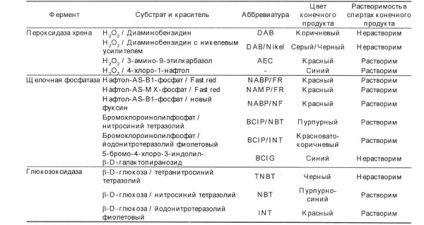
Най-широко се използва като маркер ензим има пероксидаза от хрян, която първо се прилага Накане и Pierce, алкална фосфатаза и глюкоза оксидаза. За всяка от тези ензими, има няколко основи, които под действието на ензима, за да образуват неразтворими багрила с различни цветове. Възможни комбинации от ензими и субстрати са обобщени в таблица 2.
Трябва да се помни, че пероксидаза или алкална фосфатаза съществува в тъканите на тялото, така че понякога може да се получи на фалшиви положителни резултати [2,3]. Пероксидаза намира в големи количества в неутрофили и еозинофили, следователно, за оцветяване на кръвни намазки, костен мозък и филийки имунни органи използването на този ензим не се препоръчва. Когато оцветени друга тъкан пероксидазна активност се блокира с малка добавка на водороден прекис преди инкубиране с първични антитела. Алкална фосфатаза се намира в много тъкани, така че по време на инкубация със субстрата се добавя левамизол, но трябва да се помни, че чревна алкална фосфатаза, и плацентата не се инхибира от левамизол, така че тези тъкани е по-добре да се използват други ензими. оксидаза на глюкоза може да се използва без никакви ограничения за боядисване тъкани, защото в тъкани на бозайници не е ензим.
Откриването на етикета на ензима е голяма крачка напред в развитието на имунохистохимични техники, но не всички проблеми са решени. В изследването на антигени, които се съдържат в малки количества в клетките (например, хормон рецептор на клетъчната повърхност, йонни канали), чувствителността на тези системи е неадекватна.
Следващата стъпка в развитието на системи за визуализация са се превърнали в система с помощта на антитела срещу пероксидаза или алкална фосфатаза (PAP и АРААР-комплекси). Последователността от следните процедури. Стъпка 1: Първо, първично антитяло; Етап 2: Прилагане на вторично антитяло срещу основната (свързващо антитяло), където един от свързващите места на вторично антитяло антиген се свързва с първичното антитяло, а втората е все още свободно; Етап 3: направи антитела срещу пероксидаза или алкална фосфатаза, получени от животно от същия вид, от който получените първично антитяло, антиген свързващи места, които са заети от съответния ензим. Тези антитела се свързват с втори антиген-свързващ сайт на вторични (свързване) антитела. Така, комплекс, където един антиген са свързани ензимни молекули имат две (2), който повишава чувствителността на метода за 2-кратно.
Същинският напредък бе развитието през 1979 г. от непряк имуно с авидин-биотин комплекс [5,6].
Таблица 2. Ензимите, използвани в имунохистохимични техники и техните съответни субстрати.
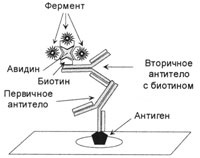
Фигура 3. Крайният комплекс в метод ABC
Комплексът е оформен в три етапа. В първия етап немаркиран първичен тялото свързан към антиген, във втория етап на вторични антитела, белязани с биотин са свързани към основната, се прибавя на третия комплекс авидин-биотин-ензим, който е прикрепен към биотин вторично антитяло.
Биотин е витамин Н, неговата химична формула изброени по-долу:
Биотин - съединение, устойчив на високи температури, за киселинни и алкални условия, е силно разтворим във вода и алкохол. Той е коензим в много реакции на (карбонизация). Биотинът може лесно да влиза в стабилно съединение с различни протеини, включително ензими и имуноглобулини. Голям брой биотин съдържа в протеини от птичи яйца, когато е свързано с авидин гликопротеин с молекулно тегло от 68 Ша. Авидин към биотин образува силно стабилен комплекс (SC-1 = 1015mol). Такъв комплекс може да унищожи само от топлинна обработка, тъй като Авидин се разрушава от отопление. Освен това, авидин има четири свързващи места, на които могат да бъдат прикрепени биотин или протеини. По този начин, авидин-биотин комплекс може да се използва като свързващ мост между антитела и ензими. За тази цел е получаване на комплекс от ензим, свързан с биотин и авидин. Центърът образува комплекс три-авидин, свързан чрез биотин свързване с ензим или флуорохром, а четвъртият остава свободен (Фигура 3). След инкубиране с вторично антитяло, свързано към биотин се добавя авидин-биотин комплекс ензим. По този начин, един антиген молекула са свързани три ензимни молекули. Този метод е наречен ABC-метод (съкращение на авидин и биотинилиран хрян пероксидаза макро-молекулен комплекс). За съжаление, този метод има недостатъци, тъй като авидин свързва с ендогенния биотин, който е в голямо количество в черния дроб и бъбреците, и също може да бъде свързана с лектини и заредени групи в тъканите, като авидин има заряд, то izoelekticheskaya лъжа в областта на рН 10,0.
По-нататъшно развитие на тази технология е получил след смяна на авидин стрептавидин - протеин с молекулна маса около 60 Ша, който е получен от микроорганизми Streptomyces avidinii (SABC-метод). Стрептавидин има същата способност да се свързват биотин, авидин и други подобни, за разлика от това не отговаря при неутрално рН не се свързва с ендогенни ензими и много по-малко с ендогенния биотин. Смяна авидин стрептавидин оставя да се намали драстично фоново оцветяване и увеличаване на чувствителността на метода е приблизително 8 пъти.
Таблица 3. томография антигени най-известните фирми
