хромов окис
Хром оксид. В СгОз система (фиг.) Има оксиди СгОз, SrO2. CR2 О3 и др. Свойства на хромов окис. са сравнени в таблица. Долна оксид СгОз метастабилна точка състава в системата за Cr-CR2 О3 присъжда да се стопи ламиниране, който се простира от 2 до 48 в.% От О. Тази система е също така, неподходящ топене оксид Cr3 O4. съществуващ при температури над
1550 ° С Той има изкривена шпинел структура.
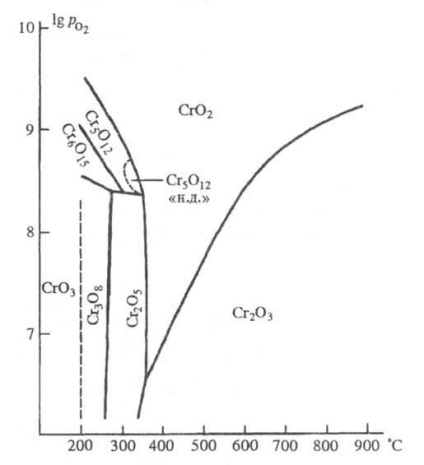
Стабилност област хромни оксиди: - налягане на кислород (Ра); "ND" - ниско налягане.
СгОз - червени кристали или черен пирофорни прах; кристална. СгОз стабилен във въздуха, неразтворим във вода, но бързо се окислява по-горе
100 ° С Реагира с HCl да отделят водороден газ с разредена H 2SO 4 и HNO3 не реагират. Готови СгОз разлагане термодинамично карбонил Cr (СО) 6. Се използва като адсорбент за пречистване на въглеводороди от O2.
Хидроксид Cr (ОН) 2 или жълто кафяво утаява от солни разтвори на Cr (II) с основа в отсъствие на кислород; разтворимост продукт от 2,0 х 10 -20; не разтворими в алкални разтвори и разредени киселини, разтворими бавно в края. киселини; във въздуха бързо се окислява.
Оксид Cr (III) (сескиоксид) CR2 3 (eskolaite минерална) има структура тип корунд (форма). Цветът му варира от светло зелено в фин материал до почти черен в големи кристали. обратимо става кафяв при нагряване зелено. Има аморфна CR2 O3. и метастабилни kubich.forma шпинел тип структура (а = 0.836 пМ) на кафяв цвят. Описван като четириъгълен. модификация (а = 0.9480 пМ, с = 0.5160 пМ) е очевидно стабилна над 1000 ° С CR2 O3 значително по-високо летлив
1200 ° С; Той се изпарява конгруентно с дисоциация по двойки; uravenie температура зависимост парата LGP налягане (mm Hg ..) = 10.62 - 25300 / T (1504-1821 К); парамагнитен, при 32 K (Нийл точка) става antiferromagnetic. състояние, преход на 0.80 кДж / мол; полупроводникови Bandgap
3.4 ЕГ; Моос твърдост 9.
Свойства на хром оксид
* Неподходящ. ** температура на кипене на 3000 ° С
CR2 O3 химически maloaktiven. Неразтворим във вода и органични разтворители, които не реагират с алкали, зол. само в силни киселини при продължително нагряване, окислява и преминава в разтвор чрез действието на горещи разтвори на персулфати или хлорати и 70% NClO4. Окислен топи KNO3 и KClO3. взаимодействие с основи се топи във въздуха. Когато синтероване с метални окиси или карбонати образува хромит (вж. Накуцване). Взаимодействие. с хлор в присъствието на въглен при 650-850 ° С по-висок
1500 ° С се намалява до Н2 метал действие. С, CO, Si, Al, Са, Mg, и така нататък. Н.
CR2 О3 получен чрез разлагане термодинамично хидроксид или хидратирана hromihromata (см. По-долу) CrO3. (NH4) 2 CR2 О7. калциниране dichromates Na или К, с въглен, последвано от промиване на Cr в изгарянето O2. висока честота получаване препоръчва оксид окисляване organochromium съединение като etilbenzolhroma. CR2 О3 се използва за получаване на метален блок. и хромови карбиди, като пигмент, органичен синтез катализатор (окисление, крекинг, хидрогениране и дехидрогениране) като полиращ материал, огнеупорни ферити компонент.
Редица хидроксиди на хром (III). Когато действието на водни разтвори на соли на хром (III), образуван от алкален или амоняк гел утаи Cr (ОН) 3 х пН2 О. хидроксид в водоразтворимост 1-10 7% от теглото при 25 ° С Нейният цвят (синьо, зелено, зелено-черно или лилаво) и химическа активност зависи от условията на отлагането. Хидроксид е лесно разтворим в минерални киселини и алкални разтвори. Както утаяване стареенето им реактивност намалява. Когато суши образува утаяване хидрат на Cr (ОН) 3 х Zn2 О, които могат да бъдат получени в кристална. форма; geksagon структура. (А = 1.230 пМ, с = 0.970 пМ, Z = 8, и т.н. От данни = 0,531 нм, с = 0.487 пМ.); плътност 1,64 гр / см 3. Maloustoychiv по време на съхранение, както и когато се нагрява до
70 ° С продължават в аморфно CR2 О3 хидрат х 5H2 О, устойчиви на
85 ° С С допълнително обезводняване получава аморфен хидроксид Cr (ОН) 3. То кристализира от типа структура на bayerite Al (ОН) 3. geksagon решетка. (А = 0.5288 пМ, с = 0.4871 пМ, Z = 2); плътност 2.90 гр / см 3; обезводнява около 150 ° С Приложени хидроксид за получаване на соли на хром (III), катализатори, ферити.
Известен също хидрат - изумрудено зелено или зелени Guillet, CR2 О3 състав PN2 х О, където п варира от 1,5 до 2; не е разтворим в минерални киселини, алкални разтвори, лесно разтворим в разтвори на СгОз 3. Стабилен във въздуха. Когато загрява до
200 ° С губи голяма част от водата (Н2 О е 0.5), но когато са изложени на въздух отново абсорбира. Напълно дехидратиран около 600 ° С Се получава чрез калциниране смес от К2 CR2 О7 Н 3ВО 3 при 500-600 ° С, последвано от промиване на Cr хидроксид чрез нагряване в автоклав с добавянето на борна или силициева киселина, или чрез редукция на Na2 CR2 О7 в органични-ти (например меласа) в автоклав. Прилага като пигмент.
SrOON оксихидроксид (или CR2 О3 х Н 2О) е известен като множествена modifikatsiy.Modifikatsiya (Grimaldi минерална) образува кристали синьо-сиво, синьо-зелено или кафяво-червен цвят; Той има romboedrich. структура (А = 0.2960 пМ, с = 1,329 нм, Z = 3, пространствена група ;. плътност от 4,12 грама / sm.Modifikatsiya зелено (gvianait минерална) има rombich решетка (а = 0.4861 пМ Ь. = 0.4292 пМ и с = 0.2960 пМ, Z = 2, пространства група EPTA); плътност 4.57 грама / см 3. трета модификация (bresuellit минерална) на червено-кафяв цвят има rombich тип диаспор структура (а. = 0.449 пМ, б = 0986 нм, с = 0.297 пМ, Z = 4, пространствена група Rbpt). описан изумрудено-зелен модификация също Орторомбичните, структурата на бьомит тип (пространства. група Cmcm). Има индикации за съществуването на друг един кубически метра odifikatsii сиво-лилав цвят.
Оксо-хидроксид е стабилен във въздуха, практически не реагира с минерални киселини и основи. Поведение при нагряване варира в различните модификации. Obezvozhivanieformy настъпва при 370-440 ° С, -modification - при 480-550 ° С, модификации - при 520-570 ° С SYUON образува при непълното дехидратация на хидроксид на Cr (III). Сплит. продукт при получаването на CR2 О3.
SrO2 диоксид кристализира в структурата на рутил тип; за данни врата пръстен има област на хомогенност (съотношение А: Cr от 1901 до 2013); феромагнит, има метален блок. проводимост; при 110 ° С се превръща парамагнитен. състояние (без промяна в структурата). при
510 ° С се разлага до CR2 О3. В въздух стабилен при продължително във вода disproportionates на SrOON SrO4 и Н2. Под действието на солна киселина, за да го окисли да освободи Cl2. Готови SrO2 разлагане CrO3 или SR5 Cr3 О8 или Ø12 при хидротермични условия; работа продукт медии магнит. запис.
Известен аморфна парамагнитен. SrO2 форма кафяво или черно. Той съдържа следи от вода и обикновено малко по-малко кислород; неговата формула понякога се пише Cr5 О9 х воден разтвор. Когато приключи дехидратация разложен. Както може да се види хидрат диоксид gidroksohromat [Cr (OH) 2] 2 SrO4. който пада от разтвори, съдържащи хром (III) и Cr (VI) при рН 3-4; Рентгенова аморфен кафяво вещество, съдържащо водни молекули допълнителни 5-5,5; междинно съединение при получаването на някои съединения с Cr.
Описани gidroksohromaty Cr (III) - е Cr (ОН) 2 (NSrO4) х 4H2 О (при изправяне на матерната луга се превръща в х SrO2 2Н2 О) и SR5 (ОН) 9 (SrO4) 3 х PN2 О. Всички тези аморфен лесно разтворими в разредена минерална киселина и алкални разтвори и дехидратира с нагряване под
250 ° С се разлагат. Gidroksohromaty хром (III) с обща формула xSr2 ySrO3 О3 X X О NH2 често се нарича hromihromatami.
Това показва наличието на окиси SR4 SR6 A7 и A11.
Оксид SR5 Ø12 - хромат (VI), хром (III). Очевидно променлив състав фаза чиито хомогенност област лежи в границите на състави SrO2,4 - SrO2,48 (според други данни от SrO2,385 до CrO2,430.). Малките черни игли. Неразтворим във вода, разтворим в разредени минерални киселини; оксид, получен при високи налягания, разграждат се с конц. H2 SO4 в кипящ. Данните в таблица. Структурните параметри са neferromagn. Висока модификация налягане. Структурата на феромагнитни. (Плътност 3.29 гр / см 3) модификация ниско налягане не е проучена.
Оксид CR2 О5 съдържа хром в две окислителни състояния, неговата структурна формула CR2 (SrO4) 2 (CR2 О7). Ние описваме две модификации - моноклинни с antiferromagnetic температура Neel под 80 К и при високи налягания съществуващите ромбично, за които предложените формула SR6 O15. Този черен кристали плака. Той не реагира с вода и разредени киселини, разтворими в конц. H 2SO 4 при стайна температура. Получава се от разлагане термодинамично Cr3 О8 CrO3 или O2 атмосфера (270-300 ° С).
Както хидрат CR2 О5 може да се счита gidroksodi-хромат Cr (ОН) CR2 О7 x2N2 На утаяване от водни разтвори. Това кафяво аморфно твърдо вещество, разтворим в разредени киселини и основи; при 100-160 ° С е дехидратиран при 250-350 ° С разлагане.
Cr3 О8 оксид [или CR2 (CR2 О7) 2 (Cr3 Ø10) - много малки тъмнокафяви кристали; antiferromagnet, температурата на Neel
Химическа енциклопедия. Том 5 >> Към списъка с членове
Свързани статии
