Ковалентното химична връзка и неговите видове и механизми на образуване. характеристики ковалентна връзка (полярност, и свързващата енергия). Йонна връзка. Металик връзка. водородна връзка
Доктрината на химичната връзка е в основата на всички теоретичната химия.
Съгласно химична връзка разбере това взаимодействие атома, който ги свързва с молекули, йони, радикали кристали.
Съществуват четири вида на химически връзки: йонна, ковалентна метални и водород.
Разделянето на видовете химични връзки е условно, тъй като всички те се характеризират с определено единство.
Йонна връзка може да се счита като ограничаващ случай на полярен ковалентна връзка.
метален връзка комбинира ковалентна взаимодействие с атоми и електрони социализирани чрез електростатично привличане между електрони и метални йони.
Веществата често липсват химичната връзка ограничаване случаи (или чисти химични връзки).
Например, литиев флуорид $ LiF $ отнася до йонни съединения. В действителност, тя призовава за $ 80% $ йон и $ 20% $ ковалентна. Правилно е така, очевидно, се говори за степента на полярност (ionicity) химична връзка.
Сред халогениди $ HF-HCl-НВг-HI-шапка $ степен на свързване полярност намалява за намаляване на разликата в стойностите на електроотрицателност на халогенните атоми и водород, и в съобщението от водород Astatide става почти неполярни $ (ЕО (H) = 2.1; ЕА (В) = 2,2) $.
Различни видове връзки могат да се съдържат в една и съща вещество, например:
- в базите: между атомите на кислород и водород в полярен gidroksogrupp ковалентна връзка и между метала и gidroksogrupp - йон;
- в соли окислени киселина: между неметални атом и кислороден киселинен остатък - полярен ковалентна между метал и киселинен остатък - йон;
- .. В соли на амоний, метиламониев др между азот и водородни атоми - полярен ковалентна и между йони или амониеви и метиламониева киселинен остатък - йон;
- на метални пероксиди (например, $ Na_2O_2 $) връзка между кислородните атоми ковалентна неполярен и между метал и кислород - йон, и т.н.
Различни видове връзки могат да преминават един на друг:
- когато става електролитната дисоциация на вода в полярен ковалентно съединения ковалентна йонна връзка;
- изпаряване на метали се превръща в метален ковалентна връзка неполярен т.н.
Причината за единството на всички типове и видове химични връзки е от същия химичен характер - електрон-ядрени взаимодействия. Образуването на химичната връзка във всеки случай е резултат от електрон-ядрен атома взаимодействия, придружени от освобождаване на енергия.
Методи за образуване на ковалентна връзка. Характеристики на ковалентна връзка: дължината на свързващата енергия
Ковалентното химична връзка - връзка, която възниква между атоми поради образуването на електронни двойки споделени.
Механизмът на образуване на такава връзка може да се обменя и донор-акцептор.
I. обмен механизъм работи когато атоми образуват двойки електрони споделени чрез комбиниране несдвоени електрони.
Съобщение осъществява чрез образуване на общата електронна двойка $ S $ електрони с водородни атоми (припокриване орбитали $ S $):
2) $ солна киселина $ - хлороводород:
Съобщение се осъществява чрез образуване на двойка общото електронно $ s- $ и електрони $ р $ (припокриващи $ S-р-орбитали $):
3) $ Cl_2 $: хлор в молекула ковалентна връзка, се формира от $ р- $ несдвоени електрони (припокриване $ р-р $ орбитали):
4) $ N_2 $: в се образуват молекулата на азотни атома между трите общи електронни двойки:
II. механизъм донор-акцептор за образуване на ковалентна връзка с примера на амониев йон $ NH_4 ^ + $.
Донор е електронна двойка акцептор - безплатно орбитална, че тази двойка може да отнеме. Свързването на амониев йон с всичките четири водородни атома на ковалентна три образувани чрез създаване на обща електронна двойка на азотен атом и водородни атоми на механизма обмен, една - за механизма на донор-акцептор.
Ковалентни връзки могат да бъдат класифицирани съгласно метода на припокриване на електрони орбитали, и преместването на един от свързаните атоми.
химическите връзки Образуваните в резултат на припокриването на електрони орбитали по линиите на комуникация се наричат $ σ $ -връзките (Sigma връзки). Sigma връзка е много силна.
$ P- $ орбитали може да се припокриват в двете области, образува ковалентна връзка поради страничното припокриване:
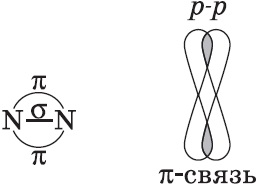
химическите връзки Образуваните в резултат на "страна" припокриване на електрони орбитали е връзката, т.е. в две области, наречени $ $ пи-връзка (пи връзки).
По степен на отклонение обща електронни двойки, свързани с един от ковалентна връзка на атоми може да бъде полярен и неполярен.
Ковалентна връзка, образувана между въглеродните атоми на същото електроотрицателност, наречен неполярен. Electron двойки не се изместват към всеки от атомите, като атоми имат една и съща ЕО - забавяне имота да се валентност електрони на други атоми. Например:
т.е. чрез ковалентна връзки са образувани неполярен молекула-неметални прост вещество. Ковалентна връзка между атомите на елементи, които се различават Електроотрицателност се нарича полярен.
Дължината и енергията на ковалентната връзка.
Характерни свойства на ковалентната връзка - нейната дължина и енергия. Дължината на връзка - разстоянието между ядрата на атомите. Химическата връзка с по-силна, по-малката му дължина. Въпреки това, мярка за якост на свързването, е на свързващата енергия. която се определя от количеството енергия, необходимо за прекъсване на връзката. Обикновено тя се измерва в кДж / мол. Така, съгласно експериментални данни, дължината на молекулите $ H_2, Cl_2 $ и $ N_2 $ $ са съответно 0.074, 0.198 и $ $ $ 0.109 пМ и енергийна връзка съответно $ 436, $ 242 и 946 $ $ кДж / мол.
Йони. йонна връзка
Си представим, че "има" два атома: Група I метален атом и неметални атом група VII. В металния атом в нивото на външната енергия е само електрон и атом неметални точно това, което липсва, е един-единствен електрон към външния си ниво е завършен.
Първият атом е лесно да се даде втори отдалечени от ядрото и слабо свързан електрон, а другият ще му даде свободно място на външната му ниво електрон.
Тогава атом, лишени от една от неговите отрицателен заряд, положително ще заредени частици, а втората ще стане отрицателно заредени частици поради получават напр. Такива частици се наричат йони.
Химично свързване, което възниква между йоните, наречен йон.
Разглеждане на образуването на тази връзка на примера добре познати на всички съединения на натриев хлорид (готварска сол):
Процесът на преобразуване на атомите, към йони е показано в следващата схема:
Това превръщане атоми на йони се появява винаги, когато взаимодейства атоми на типични метали и неметали типични.
Нека разгледаме алгоритъм (последователност) при запис разсъждения образуване йонна връзка между, например калциеви и хлорни атоми:
- Калций - елемент на основния метал подгрупата група II. Атом е по-лесно да се даде на два външния електрон, отколкото да се вземе липсващата шест: $ ↙-2e↖ → Ca ^ ↙ $.
- Хлор - елемент от основна подгрупата Група VII, неметални. Атом е по-лесно да се приеме един електрон, което му липсва, за да завършите външно ниво, отколкото да се даде седем от електроните от външния ниво: $ ↙ + 1e↖ → Cl ^ ↙ $.
- Първо трябва да намерите малкото общо кратно между обвиненията на произведените йони, това е равно на $ 2 (2 х 1) $. След това се определи колко атоми на калций трябва да се вземат, така че те дадоха двата електрона, т.е. е необходимо да се вземат един атом $ Ca $ и колко хлор атоми трябва да се вземат, така че те могат да вземат две електрони, т.е. трябва да се вземат два атома $ Cl $.
- Схематично, формирането на йонна връзка между калциеви и хлорни атоми могат да бъдат написани като:
Фигури, показващи броя на атоми или молекули са наречени коефициенти. и фигури, които показват броя на атомите в молекулата или йон, наречени индекси.
метален връзка
Запознаят с как Интеракт атома метални елементи. Метали не са обикновено съществуват под формата на отделни атоми, и под формата на парче или слитък от метал продукт. Какво държи на металните атоми в един том?
Атомите повечето метали външно съдържат малък брой електрони - $ 1, 2, 3 $. Тези електрони лесно са на разстояние и по този начин атоми се превръщат в положителни йони. Stripped електрони се преместват от един йон на друг, да ги свързване заедно. Свързване с йоните, тези електрони образуват временно атоми, тогава отделят отново и свързан с различна йонна и т.н. Следователно атомите непрекъснато се превръщат в метални йони екран и обратно.
Комуникацията между металите в йони чрез електронен социализираното наречен метал.
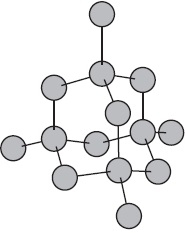
Фигурата показва схематично структурата на фрагмент от метален натрий.
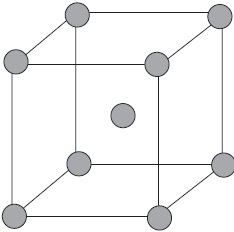
Така малък брой електрони социализирани свързва голям брой йони и атома.
Металик връзка има някои прилики с ковалентна, тъй като тя се основава на социализацията на външните си електрони. Въпреки това, когато ковалентна връзка, социализирани външен само две несдвоени електрони на съседни атоми, а когато метален връзка в социализацията на тези електрони всички атоми участват. Ето защо кристалите са чуплив ковалентна връзка, и метал, обикновено пластмаса, електропроводим и имат метален блясък.
метален връзка е характеристика на двете чисти метали и смеси от различни метали - сплав в твърди и течни държави.
водородна връзка
химичната връзка на между положително поляризирани водородните атоми на една молекула (или част от него) и отрицателно поляризиращи атоми силно електроотрицателните елементи, имащи несподелени електронни двойки ($ F, О, N $ и по-рядко $ S $ и $ Cl $), друга молекула (или част) се нарича водород.
Механизмът на образуване на връзка на водород е частично електростатично частично донор-акцептор природата.
Примери на междумолекулни водородни връзки:
В тази връзка, дори веществата с ниско молекулно тегло могат да бъдат течни при нормални условия (алкохол, вода) или втечняват лесно газове (амоняк, водороден флуорид).
Вещества с молекулно водородна връзка са кристални решетки.
Вещества с молекулна и не-молекулярна структура. решетка тип. Зависимостта на свойствата на веществата на техния състав и структура
Молекулно и не-молекулярна структура на веществата
Химическите взаимодействия не вземат отделните атоми или молекули и вещества. Веществото при определени условия може да бъде в една от трите състояния на агрегация: твърд, течен или газообразен. Свойствата на веществото зависят също от природата на химичната връзка между частиците това образуващи - молекули, атоми или йони. Според вида на комуникация различи вещество с молекулно и не-молекулярна структура.
Вещество, съставено от молекули, наречени молекулни съединения. Контакт между молекулите в такива вещества е много слаба и много по-слаба от тази между атомите в молекулата, и при относително ниски температури, те са счупени - материал се превръща в течен и в газ (сублимация на йод). Точките на топене и кипене вещества, състоящи се от молекули, които увеличават с увеличаване на молекулното тегло.
Чрез молекулни вещества включват вещества с атомната структура ($ С, Si, Li, Na, К, Cu, Fe, W $), между тях има метали и неметали.
Разглеждане на физичните свойства на алкални метали. относително малък Якостта на свързване между атоми води до ниска механична якост: алкални метали са меки, лесно да се реже с нож.
Големи размери атома доведе до ниска плътност на алкални метали: литий, натрий и калий дори по-лек от вода. В групата на алкалните метали и температурата на кипене на спад на топене с увеличаване на атомния номер на елемента, като атомни размер се увеличава и по-слаби връзки.
Веществата са не-молекулярна структура на йонни съединения. По този начин структурата има повечето от съединенията с метали от неметалните елементи: всички соли ($ NaCl, K_2SO_4 $), някои хидриди ($ LiH $) и окиси ($ СаО, MgO, FeO $), основа ($ NaOH, КОН $). Йонийски (nonmolecular) материали имат висока температура на топене и температурата на кипене.
решетки
Веществото е известно, че съществува в три състояния: газ, течни и твърди.
Твърди вещества: аморфни и кристални.
Помислете как специфичните химични връзки се отразяват на качеството твърди частици. Твърдите частици попадат в кристална и аморфна.
Аморфни вещества не разполагат с ясна температура на топене - при нагряване те постепенно омекна и се прехвърлят в течен състояние. В аморфно състояние, например, са глина и различни смоли.
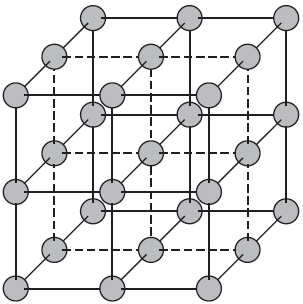
Кристални материали се характеризират с редовен режим на частиците от които те се състоят: атоми, молекули и йони - в строго определени точки в пространството. Чрез свързването на тези точки с прави линии, формуляри, пространствена система, наречена кристалната решетка. Точките на която частицата има кристална решетка наречен възли.
В зависимост от вида на частиците разположен в кристалната решетка, както и естеството на връзката между тях четири вида кристални решетки: йонни, атомната, молекулярни и метали.
Йонийски кристална решетка.
Наречен йонни решетки, в който йоните са възли. Тези вещества образуват йонна връзка, който може да бъде свързан както прости йони $ Na ^, CI ^ $ и комплекс $ SO_4 ^, ^ OH - $. Следователно, йонни соли проявяват кристални решетки, някои метални оксиди и хидроксиди. Например, кристалът на натриев хлорид се състои от променлив положителни йони $ Na ^ + $ и отрицателен $ Cl ^ - $, образуване на решетка с форма на куб. Комуникацията между йоните в кристал е много стабилна. Следователно вещество с йонната решетка са относително висока твърдост и устойчивост, те са резистентни и нелетлив.
атомен кристалната решетка на.
Наречен атомна кристална решетка, във възлите, които са отделни атоми. В такива решетки атомите свързани помежду си чрез много силни ковалентни връзки. Примери за вещества с този тип на кристални решетки могат да бъдат диамант - една от модификациите на въглероден алотропна.
Повечето съединения с атомни кристалната решетка имат много високи точки на топене (например, диамант е над 3500 $ $ ° С), те са силни и трудно, почти неразтворими.
Молекулно кристална решетка.
Наречен молекулни решетки, които са разположени на възлите на молекулата. химичната връзка в тези молекули може да бъде полярен ($ HCI, H_2O $), и неполярен ($ N_2, O_2 $). Въпреки факта, че атомите в молекулите свързани много силни ковалентни връзки между молекулите сами са слаби междумолекулни сили на привличане. Така, средства, с молекулни решетки имат ниска твърдост, с ниска точка на топене, летливи. Повечето твърди органични съединения имат молекулни решетки (нафталин, глюкоза, захар).

Метални решетки.
Вещества с метална връзка имат метална кристална решетка. Възлите на такива решетки са атоми и йони (атома, че йоните са лесно превърнати в метални атоми, като техните външни електрони "в обща употреба"). Такива метали вътрешна структура, която определя техните характерни физични свойства: ковкост, пластичност, електрическа и топлинна проводимост, характерен метален блясък.
Свързани статии
