Електрическа проводимост (L) - е способността на дадено вещество за провеждане на електрически ток от външно електрическо поле. Физическата смисъла на тази стойност е обратна на съпротивление (R):
където # 961; - съпротивление, ома / m; S - проводник напречно сечение, м 2; L - дължина на проводника, т.
Разграничаване специфичен и моларното електропроводимостта на електролитни разтвори.
Специфична електрическа проводимост (# 954) - електропроводимостта на обема на разтвора, съдържащ се между две паралелни електроди площ от 1 m 2 на разстояние 1 m от друг. Специфична електропроводимост е реципрочен на съпротивление.
Устройството за измерване на електропроводимостта: ома -1 m -1 = S / m (виж - Siemens).
Електрохимията често се използва традиционен проводимост дефиниция: електрическа проводимост от дължината на материал колона 1 см и 1 cm 2 напречно сечение с размери ома -1 cm -1 = S / cm.
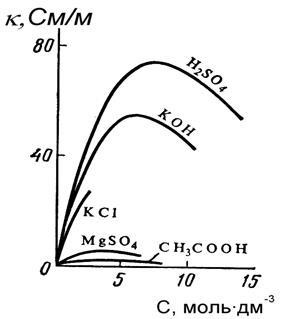
Специфична електрическа проводимост на електролита се определя от броя и заряд на йоните носещи електроенергия, както и скоростта им в електрическо поле. парцел # 954; концентриране на разтвора за силни електролити е крива с отделен връх, като слаб - максимално голяма степен замъглено и почти не се прояви (фигура 5.1.). При ниски концентрации на разтвори на силни и слаби електролити повишаване на електропроводимостта се дължи на увеличаване на броя на йони - електроенергия вектори.
Когато концентрацията повишава плътността на разтвора, намаляване на скоростта на йоните, при слабите електролитите е значително намалена степен на дисоциация; следователно # 954; за умерено слаби електролити започва да намалява в много по-разредени разтвори и увеличаване на електропроводимостта едва наблюдава и максимума на кривата, получена е много стръмен.
повишаване на температурата на 1 К увеличава проводимостта на 2-2.5% за силни електролити чрез намаляване на вискозитета на разтвор и уплътненията хидратни йони, и разтвори на слаби електролити - чрез увеличаване на степента на дисоциация в случай на ендотермични реакции на електролита разтваря.
Големината на електрическата проводимост, различни от тези, изброени фактори влияят валентност (зареждане) йон: по-голям заряд йон, толкова по-голям размер на електроенергия носи.
Моларното електрическа проводимост (# 955) - електропроводимостта на обема на електролитен разтвор, съдържащ 1 мол еквивалент от разтворено вещество, поставен между две паралелни електроди на разстояние 1 m от друг. Единицата за моларен електропроводимост е: Виж # 8729; т2 / мол.
Специфична моларен електропроводимост и са свързани с:
където С - моларна концентрация на разтвореното вещество мол / л; # 955; - моларно електропроводимостта, S # 8729; т2 / мол; # 954; - специфичната електрическа проводимост S / M.
зависимост # 955; на скоростта за единични моновалентни йони, изразени от уравнението:
където U + и U-- абсолютната скорост на положителни и отрицателни йони, съответно, # 945; - степента на дисоциация на електролита, F - Фарадей константа.
За силни електролити, можете да вземете = 1, така че
Произведенията са наречени на движението на йоните:
За много разредени разтвори (С 0 → # 945; → 1) равенство:
и където - мобилността на йони при граничната (безкрайност) разреждане са специфични стойности на йони; - електрическата проводимост на хипотетичен безкрайно разреден разтвор, характеризиращ се с пълна дисоциация на електролита и липса на сили на електростатични взаимодействия между йоните.
Уравнение (5.25) е валидно както за силни и слаби електролити и призова законът на Kohlrausch независимо движение на йони (правото на добавка електропроводимост). Съгласно закона Kohlrausch, моларното електрическа проводимост в ограничено разреждане е сумата от мобилности на йони при ограничено разреждане.
Числените стойности на мобилността на йон и се оценяват за почти всички йони и са дадени в справките. Например, като се използват модели на данни, моларното електропроводимостта много разреден разтвор на оцетна киселина може да се определи:
Сравняване на цифровите стойности на различни йони показва, че аномално високи стойности на електрически проводимости във воден разтвор имат хидрониев и хидроксилни йони. Това се дължи на механизъм реле за преместване на споменатите йони в разтвор. Следователно разтвори на киселини и основи в сравнение със солеви разтвори в подобни концентрации имат по-висока електрическа проводимост.
В разредени разтвори на слаби електрически електролити взаимодействие между йоните е малка, поради:
От израза (5.26), че степента на дисоциация на слаб електролитен разтвор, когато концентрацията може да бъде определена с помощта на експериментални данни на електрически стойности на проводимостта на кътник нейните разредени разтвори. Тъй като електролитът е постоянна, промяната в електропроводимостта на разредения разтвор на слаб електролит преобличане концентрацията му се определя само от зависимост от концентрацията на разтвора.
В разтвори на силни електролити промените в електропроводимостта с моларна концентрация поради влиянието на електростатично взаимодействие на йони на тяхната скорост на движение.
Парцел моларното електрическата проводимост от концентрацията на разтвора за слаби електролити изразена стръмно намаление с нарастваща концентрация от кривата на зависимостта същото силни електролити (фигура 5.2).
Фигура 5.2. Зависимостта на моларните електрическа проводимост слаби разтвори (1) и на тежката (2) на концентрацията на електролита.
Зависимостта на моларното проводимостта на разтвора на концентрацията на силни електролити е изследвана от много изследователи. Най-добре известно емпирично уравнение за Kohlrausch разредени разтвори, наречен закона на корен квадратен :. (5.27), където ч - емпиричен коефициент. Тази връзка се потвърждава от многобройни експерименти и теоретична основа, на теория Дебай - на Huckel - Onsager.
Според тази теория, намаляването на моларното електропроводимостта на разредени разтвори на силни електролити с увеличаване на концентрацията на електролита се дължи на намаляване на скоростта на движение на йони поради електростатичните взаимодействия на йони заобиколен техните йонни атмосфери, движението на йони в електрическо поле.
изследователски метод се основава на измерване на електропроводимостта на електролитни разтвори - Conductometry. Този метод е прост, точен, ни дава възможност за решаване на редица важни задачи за научни изследвания и производство. Измерване на електрическата проводимост на разтворите, определяне на алкалността на органични киселини, разтворимостта и продуктът разтворимостта на слабо разтворими съединения и степента на дисоциационната константа на слаб електролит, степента на минерализация на почвата, водата и почвата. Широко използвани кондуктометрично титруване различни (особено мътен) разтвор.
Опитно определяне на електропроводимостта на електролитния разтвор се базира на резистентност разтвор измерва чрез преминаване на електрически ток метод компенсация. За тази цел верига мост (фигура 5.3):
Фигура 5.3. Апарат за измерване на електрическото съпротивление на разтвора: AB - slidewire с фиксирани стойности на съпротивлението в различните позиции на плъзгащ контакт C; Rm - устойчивост кутия; Rx - кораб с изпитвания разтвор, който трябва да се определи устойчивостта; G - нула инструмент (галванометър или осцилоскоп); - висока честота генератор на ток.
С подвижния контакт на rheochords AB постигне настояща или минимум в компактдиска с верига. В този случай, връзката :. от тук:
ток променлив на висока честота (в схемата за измерване) се използва, за да се избегне електролиза ефекти върху електродите в съда с изпитвания разтвор, и за намаляване на капацитет.
Пример 5.3. Две никел плочи с площ от 4 cm2 всеки, са разположени успоредно един на друг на разстояние от 11 см. В пространството между тях се запълва с разтвор на 0.34 М NiSO4. Моларен електропроводимостта на този разтвор е равен на 98,7 · cm 2 / мол. Какво е променливо напрежение, за да се приложи към плочите на силата на тока е равна на 0.07 А?
1. За изчисляване на устойчивостта на разтвора се изчислят стойностите на проводимостта на моларното електропроводимостта:
2. Изчисляване на съпротивлението на разтвор:
3. Изчислена по закона на Ом, силата на тока в електродите:
Пример 5.4. Специфичната електрическата проводимост на 0.05 М разтвор на амониев тиоцианат е 0,572 х 10 -2 S / cm. Изчислете степента на дисоциация на солта.
1. Ние очакваме моларното електропроводимостта съгласно уравнението (5.21):
2. В директорията намерят стойностите на мобилността на йони се изчислява в съответствие с уравнението (5.25):
3. степента на дисоциация на броя на амониев тиоцианат съгласно уравнение (5.26):
Пример 5.5. Моларен електропроводимост от 0,02 М разтвор на оцетна киселина е равна на 12.77 · cm 2 / мол. Изчислява дисоциационната константа и рН на този разтвор.
1. Според референтните данни при 25 ° С за ограничаване моларен електропроводимостта на оцетна киселина е:
2. Изчисляване на степента на дисоциация на оцетна киселина, съгласно уравнение (5.26):
3. изчисляване на дисоциационната константа на оцетна киселина, съгласно уравнение (5.2):
4. Тъй като оцетна киселина е слаб електролит, концентрацията на водородните йони, получени от електролитна дисоциация на киселината, ще бъде:
5. Изчислете рН с оцетна киселина:
Електролиза - процес, при който химични реакции протичат под въздействието на електрически ток от външен източник, където електрическата енергия се превръща в химично. Чрез взаимодействие електролиза може да се извърши, което не може спонтанно поток.
Електролизата се провежда в електролитни (електрохимични клетки), състоящ се от два електрода, потопени в разтвор на електролит.
Отрицателно зареден електрод, при които процесът на възстановяване (добавяне на електрони), наречен катода:
Положително зареден електрод където настъпва окисление (откатни електрони), наречен анода:
Като резултат от електролизата на електродите се освобождава вещество от електролитен разтвор и променя състава си до повърхността на електрода. Химичните трансформации в електролизата зависи от естеството на електролита и разтворител, материал електрод и наличието на други вещества в разтвора.
Свързани статии
