Всяка молекула, йон или свободен радикал, като само локализирани електрони д може да бъде представен чрез формулата, наречен Lewis структура, която показва локализацията на електрони. В Люис формули показват само валентен електрон - те могат да влязат в ковалентна връзка или се прекрати. Следните общи правила, използвани за писане на Люис конструкции:
1. Общият брой на валентните електрони в молекулата (както йон или радикал) трябва да е равна на сумата от всички външни електрони обвивка, положителния заряд на плюс или минус в случай на отрицателни йони.
2. несподелени електрони (самостоятелно или пара) форма само част от външната обвивка на един атом, и електроните, участващи в образуването на ковалентна връзка, са част от външната обвивка и двете от тези атоми. Атомите на елементи на втория период може да бъде не повече от осем валентните електрони (правило октета). В случаите, когато строителните конструкции е възможно, с броя на валентните електрони в атомите, или по-малко от осем или осем, са реализирани с структури октет на електрони, тъй те имат по-ниска енергия. Например, етилен има структурата
Една молекула кислород има бирадикален структура с по-ниска енергия от структурата на двойната връзка, но в този случай всеки кислороден атом присъства като електрона осем несдвоени електрони са поставени на една и съща за двете atomav -MOD, т.е. октет правило се съхранява.
3. Обикновено формална гледна такса за всеки атом. Предполага се, че атомът има всички несвоен електроните, но само половината от електрони, участващи в образуването на ковалентна връзка. Излишъкът от електрони, принадлежащи атом предизвиква отрицателен заряд, както и липсата на - положително.
електроотрицателност
Електрон облак от атом, свързващ две идентични, симетрично (по отношение на междумолекулна равнина връзка и я разделя на половина), във всички други случаи, плътността на електрони е изместен по една от тях. Този вид атракция се нарича електроотрицателност. Казват, че атом, към който електронната плътност се премества в по-голяма степен, е по-електроотрицателна. Електроотрицателност атома зависи от природата, околната среда и хибридизация. Има различни количествени характеристики на Електроотрицателност. Най-известният Полинг скала въз основа на задължителни енергиите на двуатомни молекули. А -В свързваща енергия се приема средната аритметична стойност на свързващата енергия на молекулите А и В -A -B. Така получените относителната електроотрицателност. За стандарт приемане електроотрицателност на електроотрицателни елементи - флуор. В тази скала, флуорен атом е дължи на електроотрицателност равно на 4. Електроотрицателност на всеки получен от разликата между действителната свързване енергия A-B и средната аритметична стойност на свързващите енергии на А и В -A -B формула (разлика означават ) елемент:
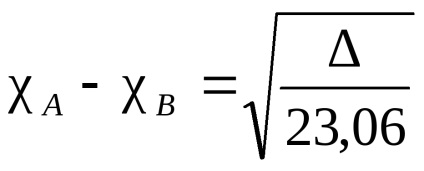
където
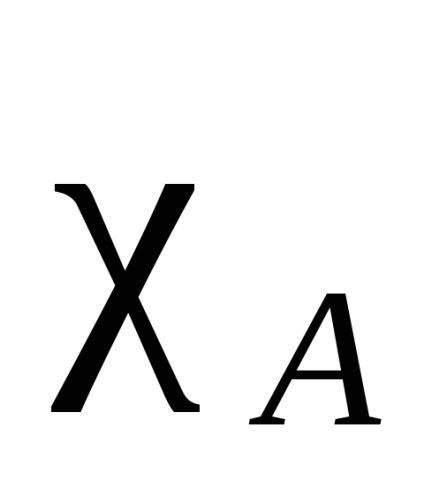
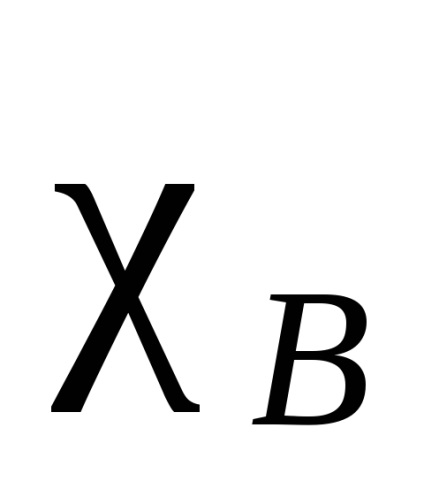
Други подходи са базирани на различни принципи. В някои от тези подходи могат да бъдат изчислени за различни Електроотрицателност валентни състояния, различни хибридизации (SP въглероден атом е по електроотрицателен от 2. SP което от своя страна е по-електроотрицателните от SP 3), както и първични, вторични и третични въглеродни атоми. Освен това е възможно не само да се изчисли electronegativities атоми, но за групите (Таблица 1).
Таблица 1 Електроотрицателност въглерод в зависимост от околната среда и хибридизация.
Свързани статии
