Наблюдава Дроселиращ ефект и Joule-Thomson NY на опит в 1852 Г. [експерименти е установено, че чрез дроселиране работа температурата на флуида промени. Това явление се нарича Джаул-Томсън ефект. Промяната на температурата чрез дроселиране се дължи на факта, че във всеки реален газ, сили на привличане и отблъскване между молекулите-ТА. Когато се разширява газ дроселиране се случи, придружено от увеличаване на тях, по причини дистанция. Всичко това води до намаляване на вътрешната енергия на работното гориво, свързани с разходите, Рабо вас, които, от своя страна, води до промяна на температурата.
идеалната температура на газа в резултат на Дроселирането не променя Xia и Ефект на Джаул-Томсън в този случай е равна на нула. По този начин, промяната на температурата на недвижими газ, когато дроселираща се определя от свойствата на отклонение на реалната газ от идеала, поради междумолекулни сили.
Разграничаване температурна разлика и интегрални газта ефекти. В диференциален ефект на температурни промени на Joule-Thomson от безкрайно количество, и когато неразделна - до ограничен-та стойност. Ако налягането на газа се намалява с безкрайно бяха ранг-DP, тогава е безкрайно промяна на температурата, т.е. Dti = AI DPI или
Стойността на AI се нарича диференциална температура Joule-Thomson ефект. Стойността на може да бъде определена от уравнение (вж. § 5.48)
Като се има предвид, че не дроселен промяна енталпия (ди = 0), полу-срт
Ефектът на газта може да бъде положително, отрицателно и равно Ним нула. Положителен ефект настъпва газта в случая, когато в droselirovanii температура газ се понижава. Отрицателни - когато в Witzlaus. Ако температурата на инвариантността на дроселиране когато се наблюдава до нула Ефект на Джаул-Томсън. Състояние недвижими газ чрез дроселиране, когато получи регулаторен ефект е нула, се нарича точката на инверсия. В този момент, има ефекта на промяната на температурата на знак. Ако температурата на газа е по-ниска от температурата perod дроселираща Инвър тези, газът се охлажда чрез дроселиране, ако повече - след това се загрява.
С цел да се намерят условия, при които има промяна на температура или газ-RY остава непроменен, е необходимо да се анализира уравнение-на (7.19) се записва под формата
Дроселиране DP <0, так как давление газа всегда уменьшается. Теплоемкость ср - величина положительная. Отсюда следует, что знак dT
Това зависи от знака и израз винаги се противопостави.
при Т (DV / дТ) р - V = 0 дТ = 0. случай, дТ = 0 може да се използва
получаване инверсия температура THH.
Последният експресията се нарича инверсия уравнение крива (кривата на която ефект дроселен е нула).
Интегрална Joule-Thomson ефект се определя от уравнението неразделна-rirovaniya (7.20)
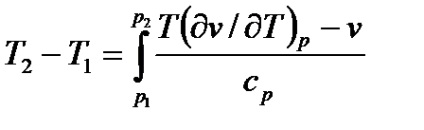
Техниката е доста често трябва да се справят с газообразен vesche-stvami представляващ механична смес от отделните газове, със свойства, приближаващи идеалните газове.
Например, атмосферния въздух е газова смес, съдържаща азот-проводящ, кислород, въглероден двуокис, водна пара и редица други газове. Необходимо е Оперативния определяне на параметрите за решаване на редица практически проблеми.
Газова смес е смес на отделните газове, химически круша-ал един с друг, т.е. всеки газ в сместа е напълно запазва всички свойства и заема целия обем на сместа. Налягането, което се създава от всяка отделна молекула на газови смеси, при условие, че газът е в същия размер в същото количество и при същата температура като сместа наречен частично (частично) налягане.
Ние приемаме, че всяка отделна газова смес удовлетворява уравнението (2.7), т.е. Той е идеален газ. Следователно, параметрите на газовата смес, както и могат да бъдат изчислени от уравнението Clapeyron
където всички количества в уравнението свързани с газовата смес.
Според закона на Далтон общо налягане идеален газ сместа е равна на сумата от парциалното налягане на газове, включени в сместа
където р - налягане на сместа; отделните частични налягания на газовата смес.
Газовата смес, може да бъде определена маса, обем и мол фракции.
Мас фракция - масовото съотношение на всеки газ към общото тегло на сместа
Сумата от акциите е равен на една
Обемната фракция - съотношението на частичното (намалено) количеството на всяка втора газова смес на общия обем
газ; V - обем на сместа от газ.
Частичното обем - обем, който ще бъде заета газ, ако неговото налягане и температура са равни на параметрите на газова смес.
Обемната фракция на всеки газ е с постоянна температура на закона на Бойл
Добавянето на тези уравнения срок от термин, ние откриваме, че сумата на частичното OBE-Mov равен обем на сместа (законът на Амага)
Ако добавите до обема на дяловете, получаваме
От закона на Бойл (при постоянна температура) трябва пи / р-Vi / V. тук
Последният формула позволява да се определи на Кръглозвенн-nents частични налягания на сместа, ако е известно насипния състав.
Настройка смес моларни фракции е както следва. На първо място, ние намираме броя на моловете на всеки компонент на сместа съгласно зависимостите
където М1. М2. .... Mn - брой молове от всеки компонент; μ1. μ2, ..., μn-п-молекулно тегло, съответстващо на смес от компоненти.
Следователно всички газовата смес съдържа м мола
Mole фракции ил (I = 1,2,3, ..., N) са в една връзка
Тъй като М = m / μ, μ молекулното тегло на сместа се определя по формулата
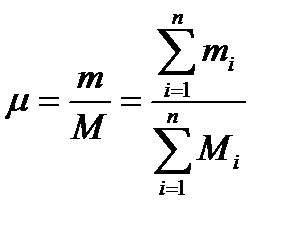
Получената стойност се нарича видно средната стойност на Molec-народен тегло на сместа. Познаването на молекулното тегло позволява формула (2.9a) R на = 8,3143 / μ намери газ постоянна R на сместа (следната формула за определяне на известен ц R е показано).
По закон Авогадро моларни количества от различни газове при еднакви налягания и температури са равни (равни обеми от газове, съдържа zhitsya същия брой молекули). Следователно, за и-тия съотношението газова смес spraved-Livo
където Vμ - обем заета от един мол на газ.
За да се получи цялата смес
Следователно, моларното фракция и обем е числено равно.
Ние извлече формула за определяне на молекулното тегло на сместа от своя Ob-emnomu състав. От изложеното по-горе за аз-ти компонент може да се запише
или за общата смес
Смяна в последното уравнение, молекулната маса на плътността им (на базата на закона на Авогадро), получаваме
В случая, когато газовата смес беше даден състав от теглото, от уравнението на състоянието
За да се получи налягане на цялата смес формула
Като се има предвид, че PV = MRT, да получите
От известно газ постоянна смес като се използва формулата (2.9a), но могат да намерят молекулното тегло на сместа.
Свързани статии
