Делокализация молекулно орбитален с метали
Как електроните могат да се движат през парче метал? Каква е разликата между метал и изолатор? Какво е полупроводникови? Защо метали се загряват при движение на електрони? Какво е свръхпроводимост?
За да се отговори на първите три въпроса, е необходимо да се разшири обсъждането на разширените молекулни орбитали, които са намерени в молекули на ароматни съединения, като бензен и нафтален (виж гл. 18) за MO макроскопски парчета метал и други материали. За да отговорим на последните два въпроса, ще трябва да се преместят от обсъждане на ефекта на топлинните трептения на атомите, които съставляват част от метал, за да обсъдят движението на електроните в метала.
Глава 10 от молекулата на водород в дискусията, разбрахме, че две атомна орбитална на водорода, образуват две молекулни орбитали - свързване и antibonding. В случай на бензен, видяхме, че шестте атомни PZ орбитите - един от всеки въглероден атом - форма три свързване и три antibonding МО. В десет нафтален PZ атомна орбитала комбинират, за да образуват десет MO - свързване на пет и пет дезинтегриращи. Във всеки случай, на Министерството на отбраната покрива цялата молекула. В глава 11, посветена на периодичната таблица на елементите, казахме, че натрий (Na) е метална, защото има един електрон (3S) над конфигурация неон затворена обвивка. Na това лесно дава електрон да образуват соли като готварска сол NaCl. NaCl се разтваря във вода и се превръща в йоните Na + и Cl -. Както вече споменахме, в твърдо състояние е Na метал и поведение на електроенергия, а сега ние сме готови да се обясни защо.
Да разгледаме за стартиране 3s орбитални на две натриеви атоми, които са съседни един на друг и да си взаимодействат. В натриеви 3s електрон на валентност, която участва в образуването на връзки. В горната част на фиг. 19.2 показва енергийните нива на двете 3s атомна орбитала, молекулните орбитите от свързващия. Нивото на енергията на един от тях МО е по-ниска от тази на атомните орбитали. Той се свързва МО. Други МО има по-високо ниво на енергия - е antibonding орбитална. В средната част на фигурата показва, че три атомни орбитали формират три MOS. По-долу показва ситуацията с шест съдействащи натриеви атоми. Шест 3s атомни орбитали са обединени в шест МВР - три свързване и три antibonding.
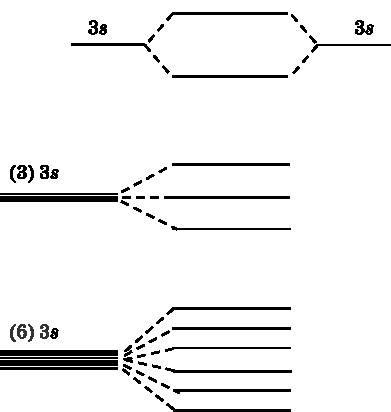
Фиг. 19.2.Vverhu: 3S-две атомна орбитала натриев взаимодействат и да генерира два молекулни орбитали - един с ниска енергия (свързване) и с по-висока (antibonding). В средата на три атомни орбитални 3s-реагират и образуват три MOS. На долния етаж: шест ядрен-3s орбитали са обединени в шест MI
Всеки атом има един Na 3s-електрон, който отива за запълване МО. В система с шест натриеви атоми за попълване MO ще бъде шест електрони. Всяка MO може да приеме два електрона с противоположни завъртания (един насочени нагоре, а другата - надолу). Ето защо, с три МО ще бъде запълнена с електрони с най-ниска енергия, т.е. свързване МО. Три МО с по-високи енергии ще бъде празно.
Сега трябва да се помисли какво ще се случи в случай на много голям брой на взаимодействие натриеви атоми. Обърнете дължина прът 10 см и диаметър 1 мм. състояща се от натриев (вж. фиг. 19.1). В такива размери, броят на Na атома, които ще включват прът, да бъде N = 2 • 21 октомври (два милиарда трилиона) Na атома. Два милиарда на милиарди атомна орбитала 3s комбинирани два милиарда трилиона молекулни орбитали. Както в случая на бензен и нафтален MO, МО натриев прът трябва да се счита за включване на цялата система, а именно, от цяло парче метал.
