Амоняк, NH3. Обикновено химично съединение на азота с водород. Един от най-важните продукти на химическата промишленост; Синтез на амоняк от водород и азот във въздуха - основният метод за получаване на т п .. свързан азот. В природата, образуваният амоняк при разлагане на органични азотсъдържащи вещества. Името "амоняк" - съкратено от гърка. Халс ammoniakos или броня. сол ammoniacus; т.нар нишадър (амониев хлорид), който се получава в амониев Oasis (сега Сиба) в либийската пустинята.
Физични и химични свойства. Амоняк - безцветен газ с остра задушлива миризма и пикантен вкус. Плътността на газообразен амоняк при 0 ° С и 101,3 кН / т2 (760 mm Hg. С.) 0.7714 кг / м 3. Точката на кипене -33.35 ° С -77,70 ° С т.т. tkpit 132 4 ° с, критичното налягане на 11.28 MN / т2 (115.0 кг / см2), критичната плътност 235 кг / м 3. топлината на изпарение на 23.37 кДж / мол (5.581 ккал / мол). Сухата смес от амоняк и въздух е в състояние да се взривят; експлозивност граници при стайна температура се намират в 15,5-28% амоняк. с увеличаване на температурата на границите се разширяват. Амонякът е силно разтворим във вода (при 0 ° С поглъща обем вода от около 1,200 обема амоняк при 20 ° С -. 700 обеми амоняк). При 20 ° С и 0,87 MN / т2 (8,9 кгс / см 2) лесно се превръща в амоняк, безцветна течност с плътност 681.4 кг / м 3. силно пречупващи светлината. Подобно на вода. течен амоняк е силно свързана главно поради образуването на водородни връзки. Течен амоняк едва провежда електричество. Течен амоняк - добър разтворител за много голям брой органични, както и много неорганични съединения. Дата на амоняк - безцветни кубични кристали.
Амоняк молекула има формата на пирамида с редовен тригонометрични N атом на върха; ъгли между връзки H-N-H 108 °, interatomic разстояния Н-М-Н 1,015, Н-Н 1,64.
Интересен имот на амоняк молекули е тяхната способност да структурна инверсия. т. е. за "обръщане" чрез пропускане на азот през водородни атоми образуват чрез пирамида основната равнина. Инверсия строго свързана с излъчването на определена честота, устройството за много точно определяне на времето, което е създаден на основата (молекулни генератори). Тези "молекулярен часовник" ще позволи по-специално за да се установи, че дължината на земни дни на година се увеличава с 0.43 милисекунди. момент дипол на молекула на амоняк е 1,43D. Поради липсата на несдвоен електрони амоняк диамагнитната.
Получаването и използването. При лабораторни условия, амоняк могат да бъдат получени чрез заместване на неговите силни основи амониеви соли съгласно схемата: 2NH4 CI + Са (ОН) 2 = 2NH3 + CaCl2 + 2Н2 О. Най-старият промишлен процес за производството на амоняк - отделянето му от димни газове при коксуване на въглища. Основният метод за промишлено производство на модерна амоняк - синтеза на елементите - азот и водород. предложен през 1908 г. от немски химик Е. Haber.
Най-често и икономичен метод за получаване на процесния газ за синтез на амоняк е превръщането на въглеводородни газове. Суровината е природен газ в този процес. и преминаване бутан. нефтопреработвателни газове. остатъчни газове ацетилен производство. метод РЕЗЮМЕ превръщане за получаване на азот-водород смес е при висока температура разлагане на метан и неговите хомолози на водород и въглероден окис използвайки окислители - водна пара и кислород. Чрез преобразуваната газ където добавя въздух или въздух. обогатена на кислород. Синтез на амоняк от прости вещества
протича с освобождението на топлина и намаляване на силата на звука. Най-благоприятни по отношение на равновесие. условия за образуване на амоняк са може би по-ниска температура и по-високо налягане е възможно. Не са катализатори за реакцията синтез на амоняк не се появяват. В промишлеността, за синтез на амоняк се използват изключително железни катализатори. може да се получи чрез редукция на железни оксиди сплавени с активатори Fe3 O4 (Al2 О3. К2 О, CaO, SiO2., а понякога и MgO). Важен етап в процеса на синтез - почистване на газова смес от катализаторни отрови (това включва вещества, съдържащи S, O2 Se, Р, As, CO, водна пара и др .....).
производствени методи синтетичен амоняк се различават по приложимо налягане. Система ниско (10-15 MN / т2), средна (25-30 MN / т2) и висока (50-100 мг / л 2) налягане. Най-честата система при средно налягане (30 MN / т2 и 500 ° С) (1 MN / т2 (10 кгс / см 2), за да се повиши степента на използване на газ в модерни синтез на амоняк системи използват многократно циркулиране на азот водород смес -. Кръгов амонячен цикъл (вж. фиг.).
Прясно газ (азот водород смес) и нереагирал, т.е.. Н. циркулиращите газове влизат първо във филтъра 1, където те се почистват от примеси, след това в пръстеновидното пространство на колоната за кондензация 2, давайки обратно топлината си на газ. движещ колона на тръби. След това газовете преминават през изпарителя 3, които са подложени на допълнително охлаждане и кондензация на амоняк. ентусиазирани циркулиращите газове. Охладената смес се кондензира газове и амоняк от изпарителя са насочени в разделителната част (сепаратор) кондензация колона, където течен амоняк се отделя, и като краен продукт се освобождава през тръба в резервоара 9. газообразен амоняк. излиза от изпарителя. преминаваща течност капан 4, амоняк се освобождава от течните капчици и се изпраща към инсталацията за обработка или в хладилни инсталации за втечняване. Газа. освободен от амоняк. подава от сепаратора за синтез колона 5. Колона синтез в катализатора има кутия или тава с тръбовидна дюза и топлообменника. Газа. минаваща през колона синтез, реагират един с друг; напускащ колоната газова смес се състои от 15 - 20% амоняк. Освен това, тези газове влизат в кондензатора 6, където амонякът се втечнява течен амоняк се отделя в сепаратора 7 и се подава към резервоара 9, и нереагиралият газ се циркулационна помпа 8 във филтъра 1 за смесване с прясно азот водород смес.
Амонякът се използва за производство на азотна киселина. азот-съдържащи соли. карбамид. циановодородна киселина. сода по метода на амоняк. Тъй като течен амоняк има голяма топлина на изпарение. след това. тя служи като работните средни хладилни машини. Течен амоняк и неговите водни разтвори се използват като течен тор. Големи количества амоняк да ammoniation суперфосфат тор, и смеси от тях.
Амонякът е токсичен. Той е силно дразнещ лигавиците. Остро отравяне с амоняк води до увреждане на очите и дихателните пътища, задух, възпаление на белите дробове. Максимално допустимата концентрация на амоняк във въздуха на производствени помещения се счита 0.02 гр / м 3. амоняк се съхранява в стоманени бутилки. боядисани в жълт цвят, с черен надпис - амоняк.
Литература Технология на свързания азот. М. 1966.
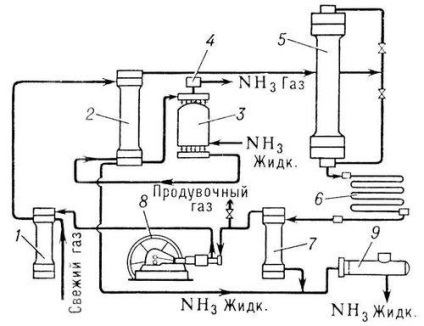
Амоняк синтез единица (процес поточна диаграма).

Свързани статии
