Аминокиселини - belkov.Belki структурни компоненти, или протеини (гръцки Protos -. Paramount), - биологичен хетерополимери, чиито мономери са аминокиселини.
Аминокиселините са с ниско молекулно тегло органично съединение като карбоксилна (-СООН) и амино (-NH2) групи, които са свързани към същия въглероден атом. въглеродния атом на страничната верига е прикрепена - радикал предоставя специфични свойства на всяка аминокиселина. Общата формула на аминокиселините е както следва:
Повечето от аминокиселината има една карбоксилна група и една амино група; Тези аминокиселини се наричат неутрални. Има, обаче, незаменими аминокиселини - с повече от една амино група, както и киселинни аминокиселини - с повече от една карбоксилна група.
Има около 200 намерени в живите организми аминокиселини, но само 20 от тях са част от протеина. Този така наречен основни или belokobrazuyuschie (протеиногенни) аминокиселини.
В зависимост от вида на радикални основни аминокиселини са разделени в три групи: 1) неполярен (аланин, метионин, валин, про-линг, левцин, изолевцин, триптофан, фенилаланин); 2) незаредени полярни (аспарагин, глутамин, серин, глицин, тирозин, треонин, цистеин); 3) полярен зареден (аргинин, хистидин, лизин - положително; аспарагинова и глутаминова киселина - отрицателен).
Странични вериги от аминокиселини (радикал) може да бъде хидрофобен или хидрофилен, което дава съответните свойства на протеини, които се проявяват при формирането на вторична, третична и четвъртична структура протеин.
В растенията всички необходими аминокиселини са синтезирани от първични продукти на фотосинтеза. Човекът и животните не са в състояние да синтезира серия от протеиногенни аминокиселини и трябва да ги получават в завършен вид с храна. Тези аминокиселини се наричат от съществено значение. Те включват лизин, валин, левцин, изолевцин, треонин, фенилаланин, триптофан, метионин; atakzhe аргинин и хистидин - от съществено значение за децата,
В разтвор, аминокиселината може да служи като киселини, така и основи, т. Е. Те са амфотерни съединения. -СООН Карбоксилната група може да дарява протон, функционира като киселина и амин - NH2 - приеме протон, по този начин, показващ база свойства.
Пептиди. амино група на една амино киселина е способен да реагира с карбоксилната група на друга амино киселина.
Така получената молекула е дипептид, -СО-NH- връзка се нарича пептидна връзка:
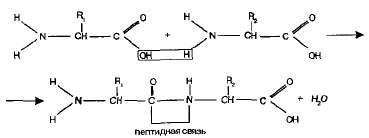
В единия край на молекулата е дипептид свободна амино група, а другият - в свободна карбоксилна група. Поради това дипептид е да поеме други аминокиселини, образувайки олигопептиди. Ако е така свързан с много аминокиселини (повече от десет), се оказва полипептид.
Пептиди играят важна роля в организма. Много олиго и полипептиди са хормони, антибиотици, токсини.
Олигопептиди са окситоцин, вазопресин, тиротропин, и брадикинин (пептид на болка), и определени опиати ( "естествени лекарства" човек), изпълняващи функцията на управление на болката. Приемането на лекарството унищожава опиоидна система на тялото, така че зависимият без доза от лекарството в голяма болка - "разпадане", което обикновено се отстранява от опиати. За някои олигопептиди включват антибиотици (например, грамицидин S).
Много хормони (инсулин, адренокортикотропен хормон и др,), антибиотици (например, грамицидин А), токсини (например, дифтерия токсин) са полипептиди.
Протеините са полипептиди, които включват молекула от петдесет хиляди до няколко аминокиселини с относително молекулно тегло повече от 10 000.
Структурата на протеини. Всеки протеин в определена среда, характерни за определена пространствена структура. В характеризиращи пространствено (триизмерни) структура е разделена на четири нива на организация на протеинови молекули (фиг. 1,1).
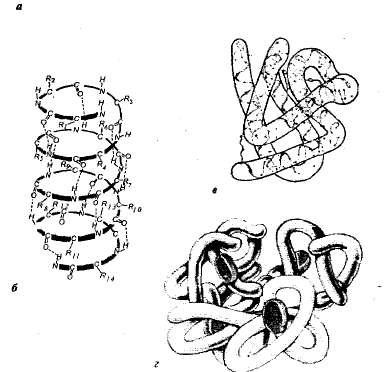
Фиг. 1.1. Протеини нива на структурна организация: а - първична структура - belkaribonukleazy аминокиселинна последователност (124 аминокиселинна единица); б - вторична структура на - poyaipeptidnaya верига усукани в спирала; в - третичната структура на протеин миоглобина на; г - кватернерна структура на хемоглобина.
Първичната структура - последователността на аминокиселини в полипептидната верига. Такава структура е специфично за всеки протеин и се определя от генетична информация, т.е.. Е. Доверете на частта на нуклеотидна последователност на ДНК молекула, кодираща активното протеин. От първична структура зависи от всички свойства и функциите на протеини. Заместване на една аминокиселина в протеин състава на молекули, или нарушение на реда на тяхното подреждане обикновено включва промяна на протеиновата функция.
Предвид факта, че част от протеин съдържа 20 вида аминокиселини, броят на варианти на комбинации им в полипептидната верига е наистина безкраен, което осигурява голямо разнообразие от протеини в живи клетки. Например, повече от 10 хиляди. Различни протеини, и те са изградени от същите основни 20 аминокиселини, открити в човешкото тяло киселини.
В живи клетки, протеинови молекули или специфични части от тях не са с удължена верига и усукани в спирала, наподобяващ опъната пружина (т.нар а-спирала) или сгънати в сгънато слой (р-слой). Такава-спирала и р-слоеве са на вторична структура. Той възниква в резултат на образуването на водородни връзки в (спирала конфигурация) в същата полипептидна верига, или между две полипептидни вериги (сгънатите слоя).
Напълно а-спирална конфигурация има кератин протеин. Това е структурен протеин на коса, нокти, човки, пера и рога; е част от външния слой на кожата на гръбначни.
По-голямата част от протеини и nonspiral спирални области на полипептидните вериги пъти в триизмерен образуване на сферична форма - глобули (типично за глобуларни протеини). В глобули е специфична конфигурация на третичната структура на протеина. Тази структура се стабилизира чрез йонни, водород, ковалентни дисулфидни връзки (образувани между серните атоми са част от по-цистит, цистин и megionina) и хидрофобни взаимодействия. Най-важното в произхода на третичната структура са хидрофобни взаимодействия; където протеинът коагулира, така че нейните хидрофобни странични вериги са скрити в молекула, т. е. защитен от контакт с вода, и хидрофилни странични вериги, напротив, са изложени на външната страна.
Много протеини с особено сложна структура, съставена от няколко полипептидни вериги (субединици), образуващи четвъртичната структура на молекулата на протеина. Такава структура е, например, глобуларен протеин хемоглобин. молекула му се състои от четири отделни полипептидни субединици (протомерите), разположени в третичната структура и не-протеин част - хем.
Само в една такава структура, хемоглобинът е в състояние да изпълнява своята функция транспорт.
Под влиянието на различни физични и химични фактори (третиране с алкохол, ацетон, киселини, основи, топлина, облъчване, високо налягане, и така нататък. D.) промяна в вторична, третична и четвъртична протеинова структура поради разкъсване водородни връзки и йонни връзки. Нарушения на процеса нативни (природен) протеинова структура, наречени денатуриране. По този начин намаляване на разтворимостта на протеина, промяна на формата и размера на молекулите, загуба на ензимна активност и така нататък. G. денатурация процес може да бъде пълна или частична. В някои случаи, на прехода към нормални условия на околната среда се придружава от спонтанно възстановяване на естествената структура на протеина. Този процес се нарича връщане на природата.
Прости и сложни протеини. Според химичния състав на изолирани прости и сложни протеини. Чрез prostm включва протеини, състоящи се само от аминокиселини, и на комплекса - протеини, съдържащи протеин и не-протеин част (протезен); простетични групи, могат да образуват метални йони, фосфорна остатък киселина, въглехидрати, липиди, и други са прости протеини от кръвния серум албумин, фибрин, някои ензими (трипсин) и т.н. За сложни протеини са всички гликопротеини и протеолипиден ..; Те са сложни протеини, например имуноглобулини (антитела), хемоглобин, повечето от ензимите и така нататък. Г.
Структура. Протеините са част от клетъчни мембрани и органели на матрицата на клетката. Стените на кръвоносните съдове, хрущял, сухожилия, коса, нокти в висши животни се състоят предимно от протеини.
Каталитичния (ензимна). Протеини ензими катализират потока на химични реакции в организма. Те осигуряват за разцепването на хранителни вещества в храносмилателния тракт, въглероден фиксиране чрез фотосинтеза и други подобни. D.
Транспорт. Някои протеини са в състояние да се свърже и да прехвърли различни вещества. Белтъци кръв предадена глобулини мастни киселини - метални йони, както и хормони, хемоглобин - кислород и въглероден диоксид. Протеинови молекули, които са част от плазмената мембрана, са включени в транспорта на вещества в клетката.
Защитен. Нейните работят имуноглобулини (антитела), кръв, предоставящи имунната защита. Фибриноген и тромбин участват в кръвосъсирването и предотвратяване на кървенето.
Съкращения. Поради приплъзване спрямо друг актин и миозинови протофибрили настъпва мускулното съкращение, както и не-мускулна вътреклетъчен редукция. ресничките и камшичета, свързани с плъзгащо движение един спрямо друг микротубулите протеин като природата.
Регулиране. Много хормони са bedkami или олигопептиди (например, инсулин, глюкагон, [антагонист на инсулин], адренокортикотропен хормон и др.).
Рецептор. Някои протеини вградени в клетъчната мембрана, са в състояние да променя своята структура под влиянието на външната среда. Тъй като сигналите са извън приемането и предаването на информация в клетката. Пример за това е фито-хром - фоточувствителен протеин регулиране растителна photoperiodic реакция и опсин - част на родопсин пигмент присъства в ретинални клетки.
Енергетиката. Протеините могат да служат като източник на енергия в клетката (след хидролиза). Обикновено, протеини, се изразходват за енергийни нужди в крайни случаи, когато изчерпани запаси от въглехидрати и мазнини.
Ензими (ензими). Тези специфични протеини, които присъстват във всички живи организми и действат като биологични катализатори.
Химични реакции се провеждат в жива клетка при определена температура, нормално налягане и подходящ киселинност. При такива обстоятелства ще вещества синтез или разграждане реакции протичат много бавно в клетката, ако те не са изложени на ензими. Ензимите ускоряват реакцията без да се променя общата си резултат от намаляване на енергията активиране, т.е.. Д. Когато присъства изисква значително по-малко енергия, за да се придаде реактивност на молекули, които реагират, или реакцията протича по друг начин с по-ниска енергийна бариера.
Всички процеси в живия организъм, пряко или непряко, проведени с участието на ензими. Например, под действието на съставките на хранителните компоненти (протеини, въглехидрати, липиди и др.) Се разцепва до прости съединения, и след това от тях се синтезират нови характерни за този тип на макромолекули. Ето защо, образование и нарушение на ензимната активност често водят до сериозни заболявания.
От организацията ензими пространствени се състои от няколко подови и пептидни вериги и обикновено имат четвъртична структура. В допълнение, ензими могат да включват не-протеинови структури. част протеин се нарича апоензим и не-протеин - кофактор (ако катионите или анионите на неорганични вещества, например Zn2- Mn2 +, и др ...) или коензим (СоА) (ако е с ниско молекулно тегло органично вещество).
Предшественици или част от много Cofer ченгета са витамини. Така, пантотенова киселина - компонент на коензим А, ниацин (витамин РР) - предшественик на NAD и NADP и др ...
Ензимните катализа при същите закони като неензимно катализа в химическата промишленост, но за разлика от него се характеризира с изключително висока степен на специфичност (само един ензим катализира реакцията или валиден само за един вид връзка). Това гарантира, че фино регулиране на жизнените процеси (дишане, храносмилане, фотосинтеза и др.), Срещащи се в клетката и тялото. Например, уреаза ензим катализира разцепването на само едно вещество - урея (H2N-CO-NH2 + Н 2О -> - »2NH 3 + CO 2), без да се упражнява каталитично действие на структурно свързани съединения.
За да се разбере механизма на действие на ензими с висока специфичност, много важно теория на активния център. Съгласно това, в молекулата, всеки ензим има една или повече част, в която катализата се дължи на близък (в много точки) на контакт между ензимните молекули и специфичното вещество (субстрат). Активното място или функционална актове група (например, ОН група на серин), или отделни аминокиселини. Обикновено е необходимо каталитичното действие да се комбинират няколко (средно от 3 до 12), разположени в определен ред на аминокиселинни остатъци. Активното центъра също е оформен с ензим, свързан с метални йони, витамини и други съединения с не-протеин природата - ко-ензими или кофактори. Освен това, формата и химическата структура на активното място така, че да може да комуникира само с определени субстрати поради тяхната перфектно съвпадение (или допълване. Допълняемост) един с друг. Ролята на други аминокиселинни остатъци в голяма молекула на ензима е да се осигури неговата молекула, съответстваща кълбовидни форма, което е необходимо за ефективното действие на активния център. Освен това, около голям ензим молекула, силно електрическо поле. Това поле става възможно ориентиране на молекулите на субстрата и придобиването на асиметрична форма. Това води до отслабване на химическите връзки и катализира реакцията протича с по първоначалният разход на енергия и следователно с по-висока скорост. Например, каталаза, една молекула на ензим може да бъде отцепена в продължение на 1 мин в продължение на 5 Mill. Водороден прекис молекули (Н202), което се случва по време на окисляването на различни съединения в организма.
Някои ензими в присъствието на субстрат конфигурация на активния център претърпява промени, т. Е. Ензимът ориентира неговите функционални групи, така че да се осигури най-висока каталитична активност.
В последния етап на химическата реакция на ензим-субстрат комплекс се освобождава с образуването на крайните продукти и свободното ензима. Свободна едновременно активен център може да приеме нов субстрат молекула.
Скоростта на ензимни реакции зависи от много фактори .. Природата и концентрацията на ензим и субстрат, температура, налягане, киселинност на средата, наличието на инхибитори, и т.н. Например, при температури, близки до нула, скоростта на биохимични реакции забавя до минимум. Този имот се използва широко в различни сектори на икономиката, особено, но в селското стопанство и медицината. По-специално, запазване на различни органи (бъбреци, сърце, далак, черен дроб) преди тяхното прехвърляне към пациента се появява по време на охлаждане, за да се намали интензитета на биохимични реакции и удължаване на живота на телата. Бързо замразяване на хранителни продукти предотвратява растежа и размножаването на микроорганизми (бактерии, гъбички и т.н.), Atakzhe храносмилателни ензими ги инактивира така че те вече не са в състояние да предизвика разлагане на храни.
Позоваването
NA Lemeza L.V.Kamlyuk НД Lisov "Биология Наръчник за университет"
Свързани статии
